I-Oバイオマーカーの可能性を見出す
開発中の研究プログラムでは、precision medicineに焦点を当て、個々の患者さんに適切な治療を適切なタイミングで提供することを早期に実現するため、研究成果を迅速に新たな治療法へと展開することを目指しています。
Precision medicineに基づいた最適な治療法を個々の患者さんに提供するため、トランスレーショナル医療への特異的かつ多面的なアプローチが求められています。がん免疫(I-O)療法が最も有効な患者集団を特定するためには、腫瘍固有のシグナル伝達や免疫生物学を含む、腫瘍微小環境の包括的な分析に基づき、臨床的特徴およびI-Oバイオマーカーを同定することが必要です。
I-Oバイオマーカーの可能性
I-Oバイオマーカーは、腫瘍微小環境の免疫反応を評価することに、運用可能と考えられます。
- I-Oバイオマーカーの分野における研究は、免疫系、腫瘍とその微小環境、並びに宿主の環境との関連性を明らかにすることを目指しています。
- これらの因子間に特有な相互作用は、抗腫瘍免疫応答の活性化と抑制のバランスに寄与します1-3。
- 腫瘍は、非炎症性から炎症性まで、免疫細胞の浸潤の程度に基づいて特徴付けられます4。
炎症性腫瘍を同定するI-Oバイオマーカーは、抗腫瘍免疫反応の存在を検測することに役立つ可能性があります3,5。
免疫系と腫瘍の間の、こうした相互作用を明らかにするI-Oバイオマーカーを同定するため、バイオマーカー研究は4つの主要分野に焦点を当てています。
I-Oバイオマーカーは、個々の患者さんに適した治療法を可能にするprecision medicineの推進に有用なツールとなり得ます。
- 患者さんごとに、免疫系、がんおよび治療法の相互作用は複雑で固有であることがあります。
- したがって、I-Oバイオマーカー開発の目標は、特定のI-O療法に反応する可能性のある患者さんを同定し、より個別化(最適化)された治療法の提案を可能にすることです3,5,8。
複数のバイオマーカーを評価することで(複合バイオマーカー法)、腫瘍およびその微小環境のより正確かつ包括的な評価を提供できる可能性があります。
I-Oバイオマーカー:免疫療法への応用に関する研究
I-Oバイオマーカー研究の重点領域について
I-Oバイオマーカーと抗腫瘍免疫活性
バイオマーカーの1つであるI-Oバイオマーカーは、抗腫瘍免疫活性の指標となります。
- 免疫系はがん細胞を見つけ出し、破壊しようとしますが、腫瘍側は免疫系からの攻撃を回避また抑制しようとします1-3。
- 抗腫瘍免疫活性とそれに対する抑制のバランスは、複数の因子間の複雑な相互作用によって規定されます1-3。
- 腫瘍微小環境における腫瘍と免疫細胞の相互作用- 腫瘍は、非炎症性から炎症性まで、免疫細胞の浸潤の程度により特徴付けられます4。
- I-Oバイオマーカーは、生体内の抗腫瘍免疫活性の評価に有用です10。
- I-Oバイオマーカーは予後予測バイオマーカー、治療反応性予測バイオマーカー、薬力学バイオマーカーとして用いられます11-14。 - I-Oバイオマーカー研究の目的は、高度な技術を用いて、腫瘍と免疫系の相互作用を調べることです5。
- I-Oバイオマーカーの存在およびその割合に関する診断検査は、腫瘍内の免疫活性を明らかにすることによって、I-O療法に対する治療反応性を予測する上でも有用である可能性があります5,15,16。 - がん生物学の理解が進み、ハイスループット技術が進歩するのに伴い、I-Oバイオマーカー検査の目標は、他の治療法との併用も含めた、個別化されたI-O療法の開発に向けた実臨床的な情報を提供することとなってきました5,17。
I-O biomarkers are dynamic and diverse
Types of Biomarkers
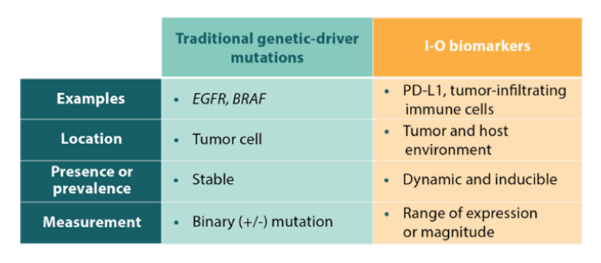
- I-Oバイオマーカーは、従来のドライバー遺伝子変異のバイオマーカーとは異なります3,18。
- I-Oバイオマーカーは、腫瘍微小環境および宿主環境内における動的な免疫活性や免疫反応性を評価します。 - I-Oバイオマーカーは、一般的にはあり/なしの2値情報ではなく、動的かつ誘導可能であり、その発現や強さの程度に幅があります7,22-24。
- ドライバー遺伝子のバイオマーカーは、特定の経路を評価し、腫瘍内のDNAの変化を評価します。 - EGFR遺伝子やBRAF遺伝子の突然変異等の従来のドライバー遺伝子の変異は、その発現パターンが存在の有無のいずれかで表される傾向があります22,23,28。
- I-Oバイオマーカーの発現状況は、がんの種類、病期、腫瘍の部位によって異なります。
- I-Oバイオマーカーは、次のようなカテゴリーに焦点をおいた研究が進められています。
I-O研究におけるバイオマーカー
バイオマーカーは治療方針の決定に有用です。
(バイオマーカーにより、個々の患者さんへの適切な治療が同定され、がん治療が個別化されることを示したモデル)
バイオマーカーとは、正常または異常なプロセスもしくは疾患の徴候を示す、組織や体液(血液等)にみられる生物学的分子、細胞、各プロセスのことです29,30。
一般的に、バイオマーカーには、予後予測バイオマーカー、治療反応性予測バイオマーカー、薬力学バイオマーカーの3つのタイプがあります。
- 予後予測バイオマーカーは、受けた治療とは無関係な、疾患の進行、疾患の再発、死亡等の臨床的イベントの生じる可能性を表します11,12。
例えば、がん細胞における、あるタンパク質の発現レベルは、治療とは無関係に、予後不良と関連付けられることがあります。
- 血清中乳酸デヒドロゲナーゼ(LDH)値の上昇等の予後不良バイオマーカーは、患者さんの転帰不良と相関します31,32。 - 治療反応性予測バイオマーカー は、患者さんが治療に対して好ましい反応または好ましくない反応を示す可能性を表します11,12。
例えば、がん細胞上のあるタンパク質の存在または発現の上昇は、特定の治療に反応した良好な転帰と関連付けられることがあります。
- 肺癌におけるEGFR遺伝子の特定の変異、または悪性黒色腫におけるBRAF遺伝子の変異等の陽性予測バイオマーカーは、標的療法に反応する可能性のある患者さんを特定することができます25。
- 結腸直腸癌におけるKRAS遺伝子の変異等の陰性予測バイオマーカーにより、標的療法に反応しない患者さんを同定することができます33,34。 - 薬力学バイオマーカーは、治療を受けた各人における生物学的反応を表します12,13。
例えば、治療前、治療中、治療後に測定されたあるタンパク質の存在は、治療が生物学的効果を有していたことを示します。
- BCR-ABLの転写レベル等のバイオマーカーを用いて、患者さんに治療への反応性があるかどうかを判定することができます35-39。
- 複数の研究から、BCR-ABL融合タンパク質は、CMLの発症、維持および進行に必須であることが示されています。治療の経過に伴うBCR-ABLの転写レベルの低下は、治療の成功を示唆することになります40,41。
腫瘍微小環境を精確に解析するためには、複数のI-Oバイオマーカーを組み合わせて検討するアプローチが必要になると考えられます。
それぞれのバイオマーカーは免疫応答を構成し、かつ制御する因子であり、動的かつ複雑です2,3。
免疫応答は活性化と抑制性の複雑なネットワークからなるシグナル経路によって制御されています42,43。
それゆえ、バイオマーカーのいずれか1つの有無だけでは、腫瘍微小環境で起きている多様な相互作用を完全に解明することはできません3,6。
バイオマーカーを組み合わせて評価することで、免疫状態をより包括的に評価できると期待されています3。
- バイオマーカー検査の目的は、個々の患者さんに適切な治療を適切なタイミングで提供することです。
REFERENCES–I-Oバイオマーカーの可能性を見出す
- Gkretsi V, Stylianou A, Papageorgis P, Polydorou C, Stylianopoulos T. Remodeling components of the tumor microenvironment to enhance cancer therapy. Front Oncol. 2015;5:214.
- Nelson D, Fisher S, Robinson B. The ‘‘Trojan Horse’’ approach to tumor immunotherapy: targeting the tumor microenvironment. J Immunol Res. 2014. doi:10.1155/2014/789069.
- Sharma P, Allison JP. The future of immune checkpoint therapy. Science. 2015;348(6230):56-61.
- Hegde PS, Karanikas V, Evers S. The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition. Clin Cancer Res. 2016;22(8):1865-1874.
- Yuan J, Hegde PS, Clynes R, et al. Novel technologies and emerging biomarkers for personalized cancer immunotherapy. J Immunother Cancer. 2016;4:3. doi:10.1186/s40425-016-0107-3.
- Blank CU, Haanen JB, Ribas A, Schumacher TN. The “cancer immunogram.” Science. 2016;352(6286):658-660.
- Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature. 2017;541(7637):321-330.
- Gibney GT, Weiner LM, Atkins MB. Predictive biomarkers for checkpoint inhibitor-based immunotherapy. Lancet Oncol. 2016;17(12):e542-e551.
- Balkwill FR, Capasso M, Hagemann T. The tumor microenvironment at a glance. J Cell Sci. 2012;125(Pt 23):5591-5596.
- Whiteside TL. Immune responses to cancer: are they potential biomarkers of prognosis? Front Oncol. 2013;3:1-8.
- Ballman KV. Biomarker: predictive or prognostic? J Clin Oncol. 2015;33(33):3968-3971.
- US Food and Drug Administration. About biomarkers. www.fda.gov/Drugs/DevelopmentApprovalProcess/DrugDevelopmentToolsQualification Program/BiomarkerQualificationProgram /ucm535922.htm. Accessed August 1, 2017.
- Gainor JF, Longo DL, Chabner BA. Pharmacodynamic biomarkers: falling short of the mark? Clin Cancer Res. 2014;20(10):2587-2594.
- Kluger HM, Zito CR, Barr ML, et al. Characterization of PD-L1 expression and associated T-cell infiltrates in metastatic melanoma samples from variable anatomic sites. Clin Cancer Res. 2015;21(13):3052-3060.
- Hendry S, Salgado R, Gevaert T, et al. Assessing tumor-infiltrating lymphocytes in solid tumors: a practical review for pathologists and proposal for a standardized method from the IIBWG: Part 1: assessing the host immune response, TILs in invasive breast carcinoma and ductal carcinoma in situ, metastatic tumor deposits and areas for further research. Adv Anat Pathol. 2017;24(5):235-251.
- Topalian SL, Taube JM, Anders RA, Pardoll DM. Mechanism-driven biomarkers to guide immune checkpoint blockade in cancer therapy. Nat Rev Cancer. 2016;16(5):275-287.
- Qiao M, Jiang T, Ren S, Zhou C. Combination strategies on the basis of immune checkpoint inhibitors in non-small-cell lung cancer: where do we stand? Clin Lung Cancer. 2018;19(1):1-11.
- Cesano A, Warren S. Bringing the next generation of immuno-oncology biomarkers to the clinic. Biomedicines. 2018;6(1):1-11.
- Kerr KM, Tsao MS, Nicholson AG, Yatabe Y, Wistuba II, Hirsch FR. Programmed death-ligand 1 immunohistochemistry in lung cancer: in what state is this art? J Thorac Oncol. 2015;10(7):985-989.
- Rizvi NA, Hellmann MD, Snyder A, et al. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science. 2015;348(6230):124-128.
- Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science. 2015;348(6230):69-74.
- Ohaegbulam KC, Assal A, Lazar-Molnar E, Yao Y, Zang X. Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway. Trends Mol Med. 2015;21(1):24-33.
- Wang X, Teng F, Kong L, Yu J. PD-L1 expression in human cancers and its association with clinical outcomes. Onco Targets Ther. 2016;9:5023-5039.
- Patel SP, Kurzrock R. PD-L1 expression as a predictive biomarker in cancer immunotherapy. Mol Cancer Ther. 2015;14(4):847-856.
- Van Allen EM, Wagle N, Levy MA. Clinical analysis and interpretation of cancer genome data. J Clin Oncol. 2013;31(15):1825-1833.
- Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer. Nature. 2002;417(6892):949-954.
- Mok TS. Personalized medicine in lung cancer: what we need to know. Nat Rev Clin Oncol. 2011;8(11):661-668.
- Jakobsen JN, Santoni-Rugiu E, Ravn J, Sørensen JB. Intratumour variation of biomarker expression by immunohistochemistry in resectable non-small cell lung cancer. Eur J Cancer. 2013;49(11):2494-2503.
- Henry NL, Hayes DF. Cancer biomarkers. Mol Oncol. 2012;6(2):140-146.
- Strimbu K, Tavel JA. What are biomarkers? Curr Opin HIV AIDS. 2010;5(6):463-466.
- Yu SL, Xu LT, Qi Q, et al. Serum lactate dehydrogenase predicts prognosis and correlates with systemic inflammatory response in patients with advanced pancreatic cancer after gemcitabine-based chemotherapy. Sci Rep. 2017;7:45194.
- Weide B, Elsässer M, Büttner P, et al. Serum markers lactate dehydrogenase and S100B predict independently disease outcome in melanoma patients with distant metastasis. Br J Cancer. 2012;107(3):422-428.
- Allegra CJ, Jessup JM, Somerfield MR, et al. American Society of Clinical Oncology provisional clinical opinion: testing for KRAS gene mutations in patients with metastatic colorectal carcinoma to predict response to anti-epidermal growth factor receptor monoclonal antibody therapy. J Clin Oncol. 2009;27(12):2091-2096.
- Sepulveda AR, Hamilton SR, Allegra CJ, et al. Molecular biomarkers for the evaluation of colorectal cancer: guideline from the American Society for Clinical Pathology, College of American Pathologists, Association for Molecular Pathology, and the American Society of Clinical Oncology. J Clin Oncol. 2017;35(13):1453-1486.
- Cramer SD, Chang BL, Rao A, et al. Association between genetic polymorphisms in the prostate-specific antigen gene promoter and serum prostate-specific antigen levels. J Natl Cancer Inst. 2003;95(14):1044-1053.
- Lilja H, Ulmert D, Vickers AJ. Prostate-specific antigen and prostate cancer: prediction, detection and monitoring. Nat Rev Cancer. 2008;8(4):268-278.
- Gaudreau PO, Stagg J, Soulières D, Saad F. The present and future of biomarkers in prostate cancer: proteomics, genomics, and immunology advancements: supplementary issue: biomarkers and their essential role in the development of personalised therapies (A). Biomarkers in Cancer. 2016;8(S2):15-33. doi:10.4137/BIC.S31802.
- Radich JP, Gooley T, Bryant E, et al. The significance of bcr-abl molecular detection in chronic myeloid leukemia patients “late,” 18 months or more after transplantation. Blood. 2001;98(6):1701-1707.
- Yuda J, Miyamoto T, Odawara J, et al. Persistent detection of alternatively spliced BCR-ABL variant results in a failure to achieve deep molecular response. Cancer Sci. 2017;108(11):2204-2212.
- Ren R. Mechanisms of BCR-ABL in the pathogenesis of chronic myelogenous leukaemia. Nat Rev Cancer. 2005;5(3):172-183.
- An X, Tiwari AK, Sun Y, Ding PR, Ashby CR, Chen ZS. BCR-ABL tyrosine kinase inhibitors in the treatment of Philadelphia chromosome positive chronic myeloid leukemia: a review. Leuk Res. 2010;34(10):1255-1268.
- Long EO, Kim HS, Liu D, Peterson ME, Rajagopalan S. Controlling natural killer cell responses: integration of signals for activation and inhibition. Annu Rev Immunol. 2013;31:227-258.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252-264.















