CheckMate 274 試験(国際共同第Ⅲ相試験)概要
本試験では、筋層浸潤性尿路上皮癌の術後患者※1を対象とした術後補助療法として、オプジーボのプラセボに対する優越性を検証するとともに、安全性も検討しました。
試験概要
試験デザイン
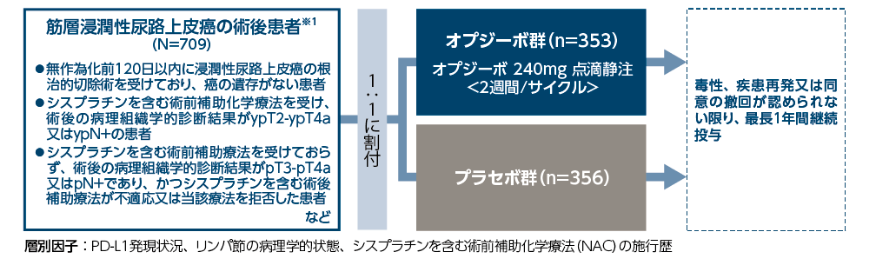
【評価項目】
有効性
主要評価項目:全症例※2及びPD-L1陽性症例※3の無病生存期間(DFS)※4
副次的評価項目:非尿路上皮無再発生存期間(NUTRFS)、全生存期間(OS)、疾患特異的生存期間(DSS)
探索的評価項目: QOL(EORTC QLQ-C30※5、EQ-5D-3L)、無遠隔転移生存期間(DMFS)、第2無増悪生存期間(PFS2)※6
安全性
死亡、有害事象、臨床検査値の評価
その他の評価項目:免疫原性、回復率、回復に至るまでの期間、治験薬の投与状況
【解析計画】
(一部抜粋)
有効性
主要評価項目:無病生存期間(DFS)の解析対象集団は、全症例※2及びPD-L1陽性症例※3とした。最終解析で必要なDFSイベント数の85%(全症例は348件、PD-L1陽性症例は137件)が認められた時点で中間解析を行い、プラセボに対する優越性を検証することとした。投与群間の比較は、有意水準を両側0.025とした層別log-rank検定により実施した。中間解析の有意水準は、O’Brien-Fleming境界型のLan-DeMetsのα消費関数により調整した。ハザード比とその両側100×(1−α)%の信頼区間は、PD-L1発現状況、リンパ節の病理学的状態、シスプラチンを含む術前補助化学療法の施行歴を層別因子とし、投与群を共変量とした層別Cox比例ハザードモデルを用いて推定した。DFS中央値はKaplan-Meier法を用いて推定し、その両側95%信頼区間は二重対数変換法を用いて算出した。3ヵ月、6ヵ月及び12ヵ月時点の無病生存率はKaplan-Meier法を用いて推定し、その両側95%信頼区間は生存関数の標準誤差にGreenwoodの公式を、生存関数に二重対数変換法を用いて算出した。
副次的評価項目:非尿路上皮無再発生存期間(NUTRFS)の解析対象集団は、全症例※2及びPD-L1陽性症例※3とした。NUTRFSのハザード比及びその両側95%信頼区間は、DFSと同じ層別因子を用いて、投与群を共変量とした層別Cox比例ハザードモデルにより推定した。NUTRFS中央値はKaplan-Meier法を用いて推定し、その両側95%信頼区間は二重対数変換法を用いて算出した。3ヵ月及び6ヵ月時点の非尿路上皮無再発生存率はKaplan-Meier法を用いて推定し、その両側95%信頼区間は生存関数の標準誤差にGreenwoodの公式を、生存関数に二重対数変換法を用いて算出した。
探索的評価項目:QOLの評価として、EORTC QLQ-C30※5とEQ-5D-3Lを設定し、それぞれ評価時点ごとの値及びベースラインからの平均変化量を記述統計量を用いて要約した。
サブグループ解析:DFSの結果に対して、年齢、性別、地域、ベースライン時のECOG PS、ベースライン時のヘモグロビン値、ベースライン時のクレアチニンクリアランス値、原発巣、尿路上皮癌亜型の存在、リンパ節の病理学的な状態、腫瘍の病理学的な状態、術前補助化学療法の施行歴、浸潤性尿路上皮癌の手術から無作為化までの期間、喫煙歴、PD-L1発現率を層別因子として、サブグループ解析を行った。ハザード比及び95%信頼区間は、投与群を共変量とした層別Cox比例ハザードモデルを用いて算出した。
安全性
その他の評価項目:免疫原性については、抗ニボルマブ抗体の発現状況を評価した。回復率及び回復に至るまでの期間は、留意すべき副作用及び免疫介在性有害事象のうち、回復に要した期間が最も長い事象で算出した。治験薬の投与状況及び投与期間中央値は、記述統計を用いて要約した。
※1:無作為化前120日以内に浸潤性尿路上皮癌の根治的切除術を受けており、癌の遺存がない患者 シスプラチンを含む術前補助療法を受け、術後の病理組織学的診断結果がypT2-ypT4a又はypN+の患者、又はシスプラチンを含む術前補助療法を受けておらず、術後の病理組織学的診断結果がpT3-pT4a又はpN+であり、かつシスプラチンを含む術後補助療法が不適応又は当該療法を拒否した患者を対象とした。
※2:無作為化された全ての被験者
※3:無作為化されたPD-L1発現[PD-L1 IHC 28-8 pharmDx(Dako社)による腫瘍細胞における細胞膜の染色率(TPS)]が1%以上の被験者
※4:治験責任(分担)医師判定
※5:European Organization for Research and Treatment of Cance(r EORTC)Quality of Life Questionnaire-Core 30
※6:無作為化された日から、後治療の全身抗癌療法後に治験責任(分担)医師が進行と判定した日、2種類目の後治療の全身抗癌療法の開始日又はあらゆる原因による死亡日のいずれかの早い時点までの期間
病理学的背景による選択基準1)
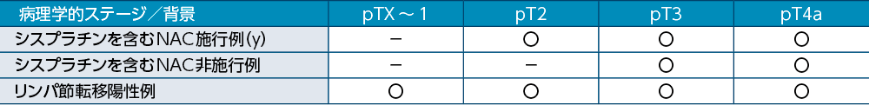
シスプラチンを含む術前補助療法を受け、術後の病理組織学的診断結果がypT2-ypT4a 又はypN+の患者、又はシスプラチンを含む術前補助療法を受けておらず、術後の病理組織学的診断結果がpT3-pT4a又はpN+であり、かつシスプラチンを含む術後補助療法が不適応又は当該療法を拒否した患者を対象とした2)。
y (yield to treatment):治療が行われた(もしくは行われている)症例を意味する。
例)ypT2とは術前療法後の組織学的な深達度がT2である3)。
投与・検査スケジュール1)
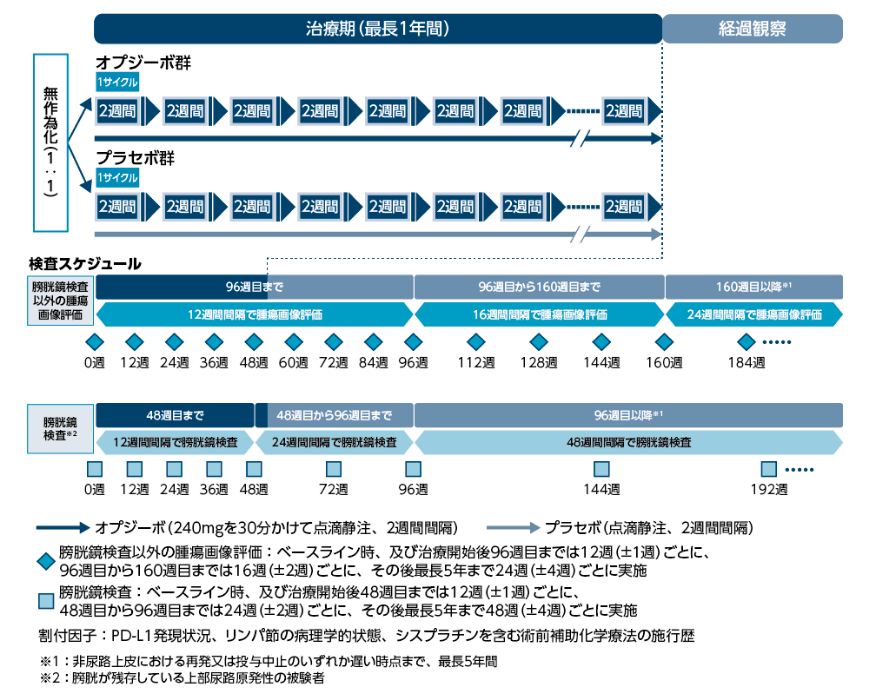
1) 小野薬品工業:国際共同第Ⅲ相(ONO-4538-33/CA209274)試験成績(社内資料)承認時評価資料
2) オプジーボ®添付文書 2022年3月改訂(第12版)
3) 日本泌尿器科学会・日本病理学会・日本医学放射線学会編、医学図書出版、腎盂・尿管・膀胱癌取扱い規約 第2版 2021; 95.より作成
患者背景(全症例)
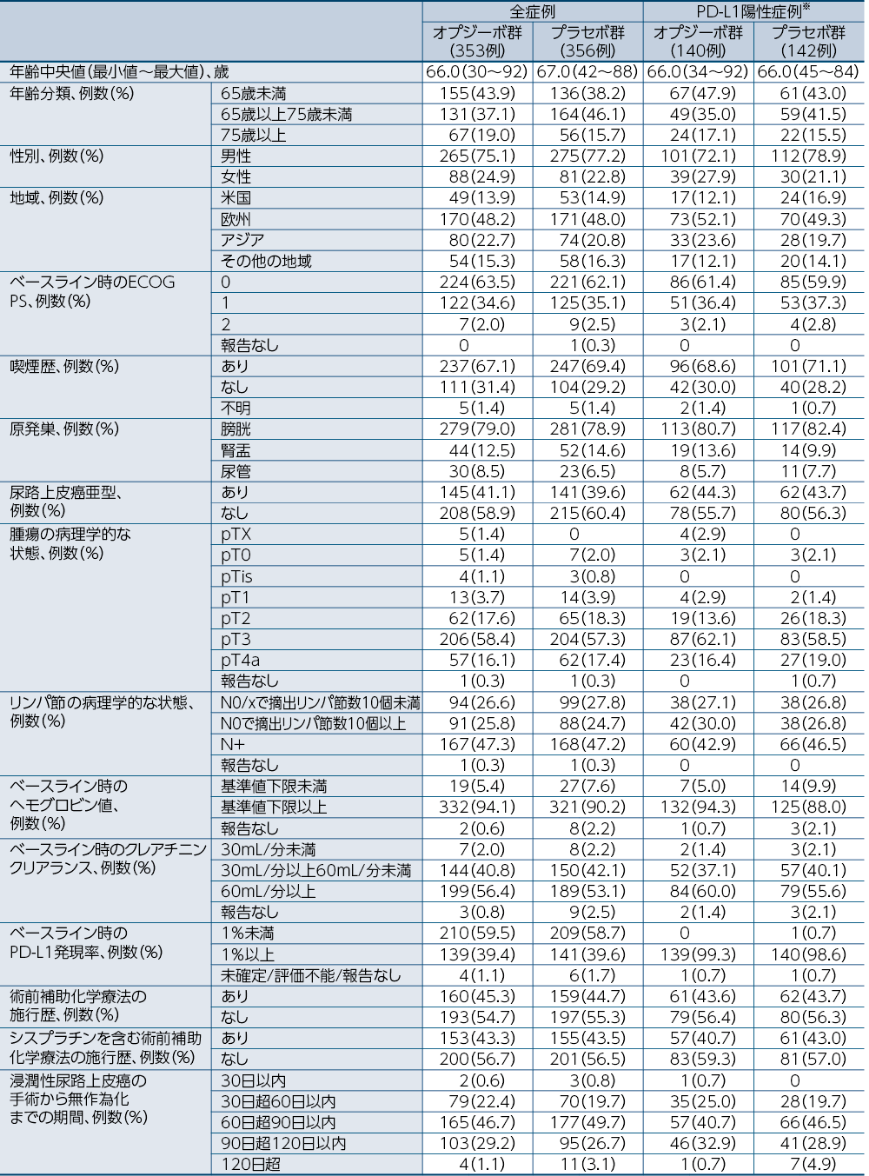
※:腫瘍細胞のPD-L1発現が1%以上
小野薬品工業:国際共同第Ⅲ相(ONO-4538-33/CA209274)試験成績(社内資料)承認時評価資料
有効性
無病生存期間(DFS:全症例)[主要評価項目]
●検証的解析結果
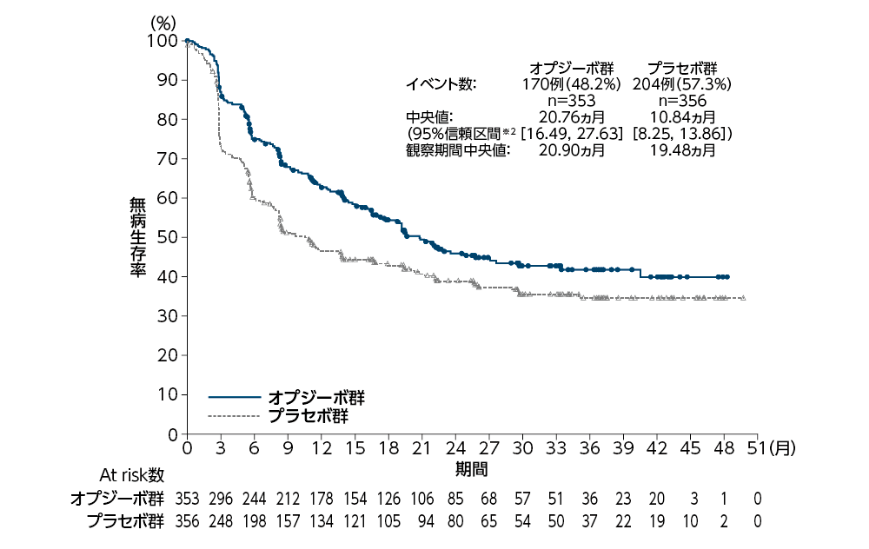
全症例における無病生存期間(DFS)中央値は、オプジーボ群で20.76ヵ月(95%信頼区間[16.49, 27.63]※2)、プラセボ群で10.84ヵ月(95%信頼区間[8.25, 13.86]※2)であり、オプジーボ群のプラセボ群に対する優越性が検証されました(p=0.0008両側:有意水準0.025、層別log-rank検定※1)1)。
オプジーボ群のプラセボ群に対するハザード比は0.70(98.22%信頼区間[0.55, 0.90]※3)でした1)。 3ヵ月時点、 6ヵ月時点及び12ヵ月時点の無病生存率[95%信頼区間]は、オプジーボ群でそれぞれ86.8%[82.8, 90.0]、74.9%[69.9, 79.2]、62.8%[57.3, 67.8]、プラセボ群でそれぞれ72.8%[67.7, 77.2]、 60.3%[54.9, 65.3]、46.6%[41.1, 51.9]でした1,2)。
※1:PD-L1発現状況、リンパ節の病理学的状態、シスプラチンを含む術前補助化学療法の施行歴を層別因子とした。
※2:Kaplan-Meier法
※3:PD-L1発現状況、リンパ節の病理学的状態、シスプラチンを含む術前補助化学療法の施行歴を層別因子とし、投与群を共変量とした層別Cox比例ハザードモデル
1) 小野薬品工業:国際共同第Ⅲ相(ONO-4538-33/CA209274)試験成績(社内資料)承認時評価資料
2)Bajorin DF, et al. N Engl J Med. 2021; 384(22): 2102-2114. [利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援をうけて実施された。
無病生存期間(DFS)のサブグループ解析[主要評価項目・サブグループ解析]
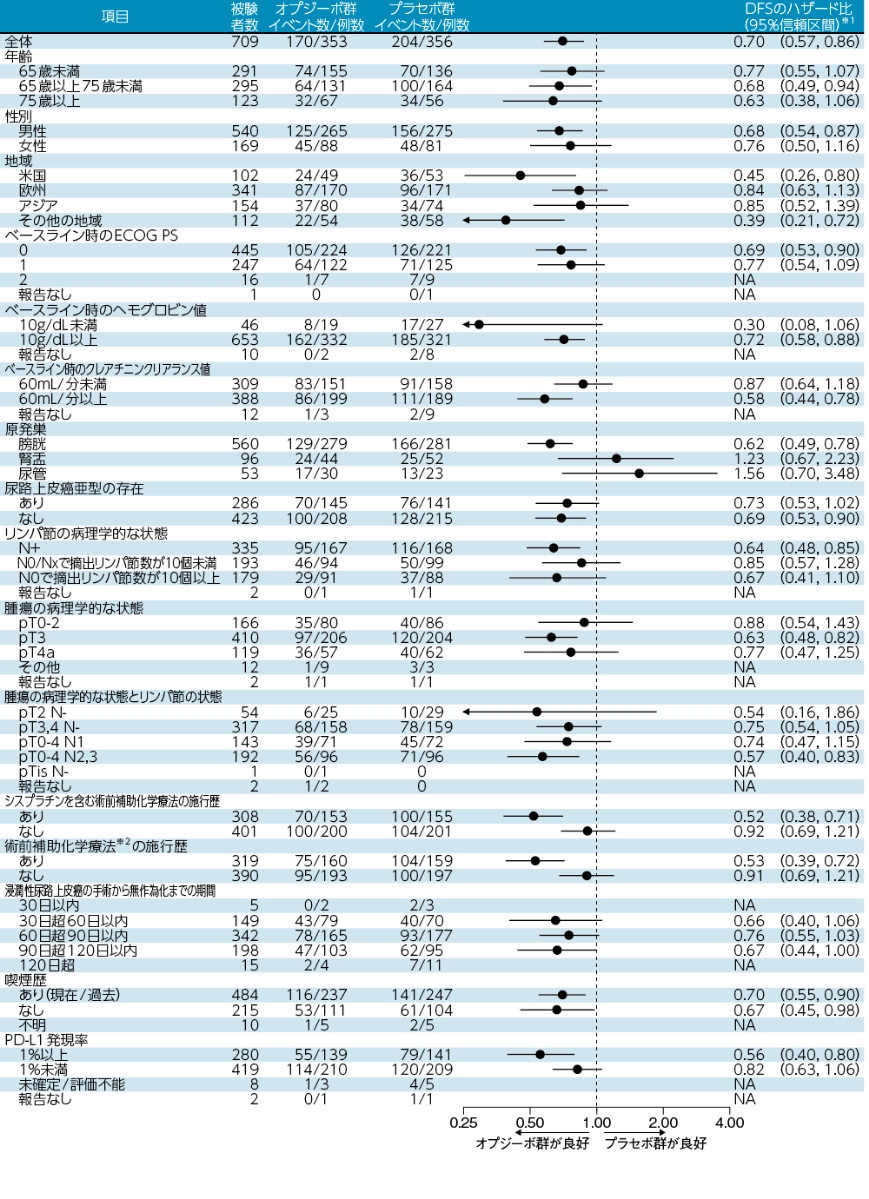
※1:投与群を共変量とした層別Cox比例ハザードモデル 層別因子はPD-L1発現状況、リンパ節の病理学的状態、シスプラチンを含む術前補助化学療法の施行歴
※2:カルボプラチン(本邦適応外)、シスプラチン、M-VAC(メトトレキサート-ビンブラスチン-アドリアマイシン-シスプラチン)、GC(ゲムシタビン-シスプラチン)、ドキソルビシン、エピルビシン、フルオロウラシル、ゲムシタビン等
Bajorin DF, et al. N Engl J Med. 2021; 384(22): 2102-2114.
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援をうけて実施された。
無病生存期間(DFS)のサブグループ解析[主要評価項目・サブグループ解析]
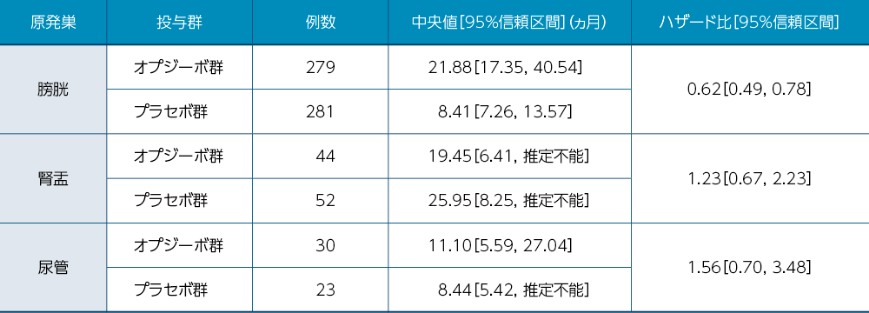
オプジーボ®添付文書 2022年3月改訂(第12版)より作成
PD-L1陽性症例における無病生存期間(DFS)中央値は、オプジーボ群で未達(95%信頼区間[21.19, − ]※2)、プラセボ群で8.41ヵ月(95%信頼区間[5.59, 21.19]※2)であり、オプジーボ群のプラセボ群に対する優越性が検証されました(p=0.0005両側:有意水準0.025、層別log-rank検定※1)1)。
オプジーボ群のプラセボ群に対するハザード比は0.55(98.72%信頼区間[0.35, 0.85]※3)でした1)。 3ヵ月時点、 6ヵ月時点及び12ヵ月時点の無病生存率[95%信頼区間]は、オプジーボ群でそれぞれ85.1%[77.8, 90.1]、74.5%[66.2, 81.1]、67.2%[58.4, 74.5]、プラセボ群でそれぞれ67.7%[59.1, 74.9]、 55.7%[46.8, 63.6]、45.9%[37.1, 54.2]でした1,2)。
無病生存期間(DFS: PD-L1陽性症例)[主要評価項目]
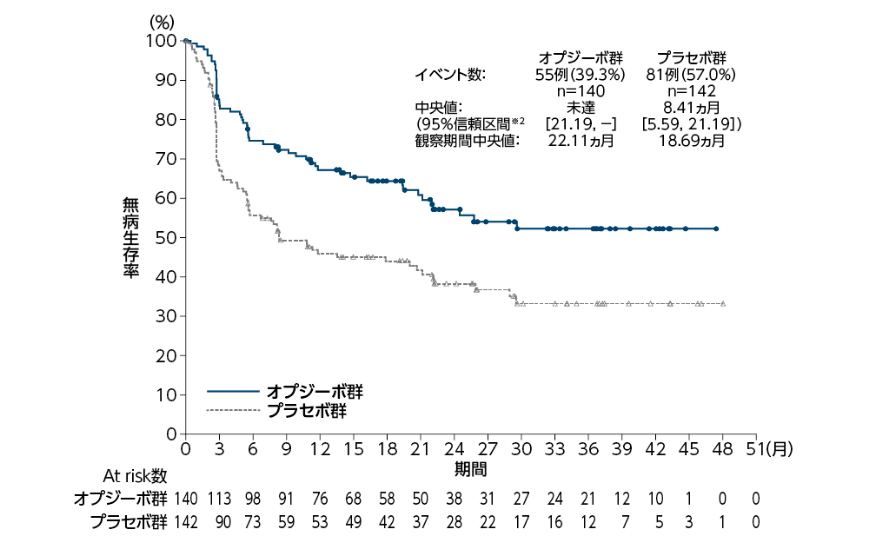
※1:リンパ節の病理学的状態、シスプラチンを含む術前補助化学療法の施行歴を層別因子とした。
※2:Kaplan-Meier法
※3:リンパ節の病理学的状態、シスプラチンを含む術前補助化学療法の施行歴を層別因子とし、投与群を共変量とした層別Cox比例ハザードモデル
1) 小野薬品工業:国際共同第Ⅲ相(ONO-4538-33/CA209274)試験成績(社内資料)承認時評価資料
2)Bajorin DF, et al. N Engl J Med. 2021; 384(22): 2102-2114. [利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援をうけて実施された。
安全性
●いずれかの群で5%以上に発現した副作用一覧
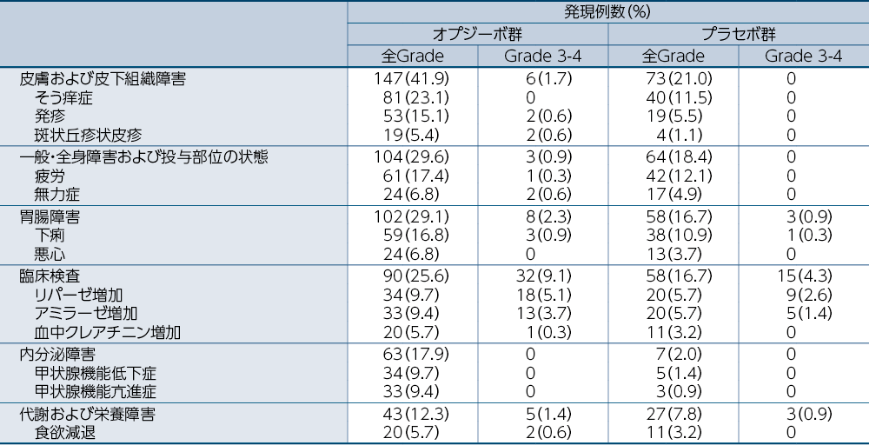
医師から報告された有害事象名は、MedDRA ver 23.0Jを用いて読み替え、CTCAE v4.0を用いて評価しました。因果関係は、「関連あり」、「関連なし」の2段階で評価され、「関連あり」と判定された場合に、副作用として集計しました。なお、「不明」と判定された場合も副作用として集計しました。 発現頻度は、最終投与後30日までに発現・増悪した副作用を対象に集計しました。
重篤な副作用はオプジーボ群9.1%(32例)、プラセボ群2.0%(7例)に認められ、最も発現率が高かったものはオプジーボ群では大腸炎、急性腎障害及び肺臓炎各0.9%(3例)、プラセボ群では大腸炎0.6%(2例)でした。投与中止に至った副作用はオプジーボ群12.8%(45例)、プラセボ群2.0%(7例)に認められ、主なもの(1%以上)はオプジーボ群では肺臓炎1.7%(6例)、発疹1.1%(4例)でした。オプジーボ群で最終投与後30日までに死亡に至った副作用は0.3%[1例(免疫性肺臓炎)]、最終投与後30日以降に死亡に至った副作用は0.3%[1例(肺臓炎)]でした。
●オプジーボ群(351例)における留意すべき副作用の発現、マネジメント及び回復
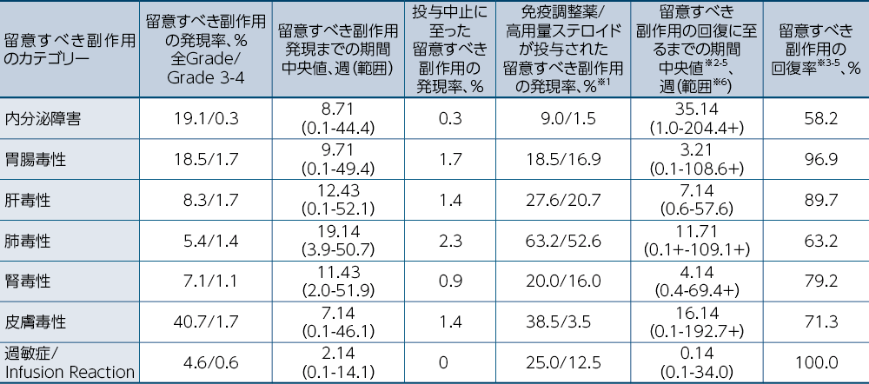
留意すべき副作用は、免疫介在性の可能性があり頻回なモニタリングと介入を必要とする副作用です。発現頻度は、最終投与後30日までに発現・増悪した副作用を対象として集計しました。
※1:母数はそれぞれの留意すべき副作用の発現があった被験者数
※2:Kaplan-Meier法
※3:留意すべき副作用を有していたが、ベースラインからの悪化が認められなかった被験者は回復の解析から除外
※4:症状の継続時点、死亡又はGrade 5の時点では未回復とした。
※5:回復は「完全な回復」又は「ベースラインまでの改善」と定義
※6:+は打ち切りを示す。
小野薬品工業:国際共同第Ⅲ相(ONO-4538-33/CA209274)試験成績(社内資料)承認時評価資料
その他
非尿路上皮無再発生存期間(NUTRFS:全症例)[副次的評価項目]
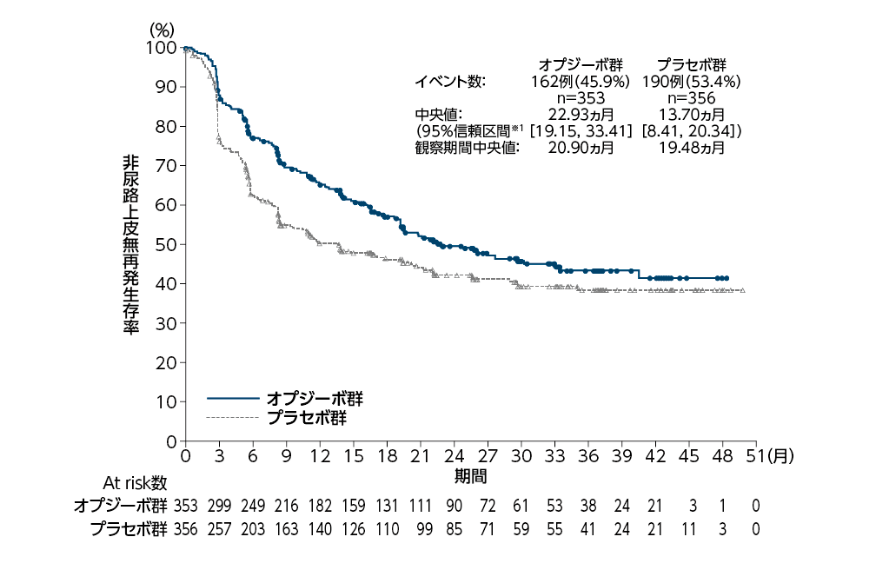
全症例における非尿路上皮無再発生存期間(NUTRFS)中央値は、オプジーボ群で22.93ヵ月(95%信頼区間[19.15, 33.41]※1)、プラセボ群で13.70ヵ月(95%信頼区間[8.41, 20.34]※1)でした。
オプジーボ群のプラセボ群に対するハザード比は0.72(95%信頼区間[0.59, 0.89]※2)でした。 3ヵ月時点及び6ヵ月時点の非尿路上皮無再発生存率[95%信頼区間]は、オプジーボ群でそれぞれ87.7%[83.8, 90.8]、77.0%[72.1, 81.1]、プラセボ群でそれぞれ76.2%[71.4, 80.4]、62.7%[57.3, 67.6]でした。
※1:Kaplan-Meier法
※2:PD-L1発現状況、リンパ節の病理学的状態、シスプラチンを含む術前補助化学療法の施行歴を層別因子とし、投与群を共変量とした層別Cox比例ハザードモデル
●投与状況(全症例)
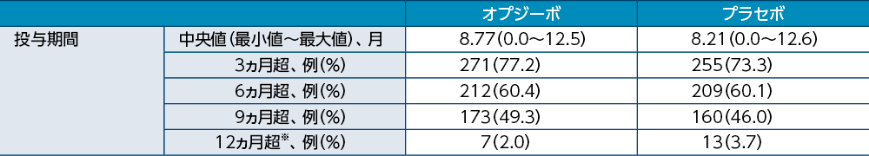
※:承認用法用量外
小野薬品工業:国際共同第Ⅲ相(ONO-4538-33/CA209274)試験成績(社内資料)承認時評価資料
QOLへの影響(全症例)[探索的評価項目]〔 参考情報〕
●EORTC QLQ-C30スコアのベースラインからの平均変化量〔参考情報〕
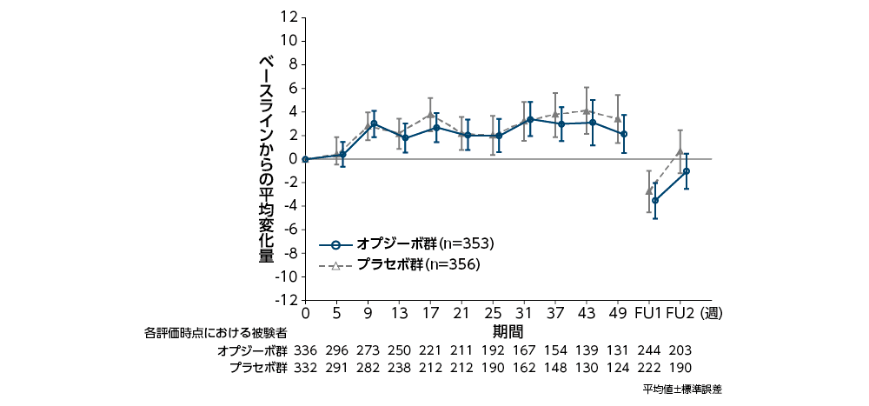
EORTC QLQ-C30:European Organization for Research and Treatment of Cancer Quality of Life Questionnaire-Core 30
●EQ-5D-3Lスコアのベースラインからの平均変化量〔参考情報〕
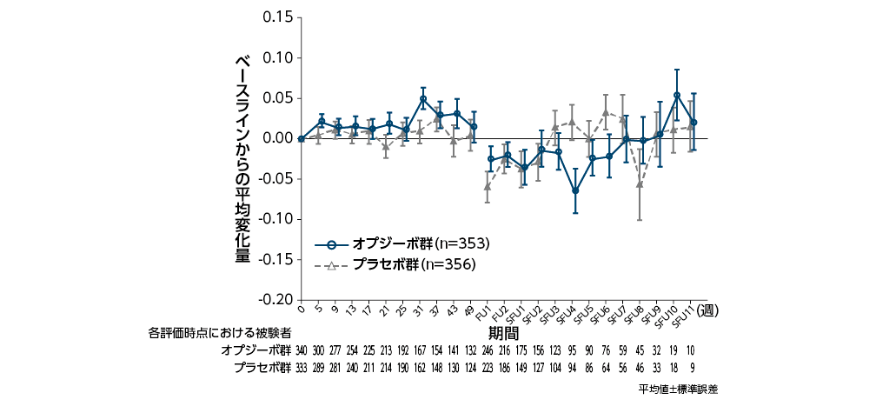
FU(追跡調査期間):FU1は最終投与から約35日後。最終投与から35日以降に投与中止になった場合は中止日。FU2はFU1の約80日後。
SFU(生存追跡調査期間):FU2から3ヵ月ごと。
4. 効能又は効果(一部抜粋)
尿路上皮癌における術後補助療法
5. 効能又は効果に関連する注意(一部抜粋)
〈尿路上皮癌における術後補助療法〉
5.24 シスプラチン等のプラチナ製剤による治療が可能な場合にはこれらの治療を優先すること。
5.25 本剤の有効性は、原発部位により異なる傾向が示唆されている。原発部位ごとの結果について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、腎盂・尿管癌においては、術前補助療法歴も踏まえ、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[17.1.28参照]
5.26 臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.28参照]
5.27 本剤の術前補助療法における有効性及び安全性は確立していない。
6. 用法及び用量(一部抜粋)
〈尿路上皮癌における術後補助療法〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。ただし、投与期間は12ヵ月間までとする。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈尿路上皮癌における術後補助療法〉
7.16 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。

















