海外第Ⅱ相試験 CheckMate 142試験(海外データ)
本試験におけるオプジーボの用法及び用量は、現在承認されている用法及び用量と異なります。
フッ化ピリミジン系抗悪性腫瘍剤を含む化学療法歴のあるMSI-High※1又はdMMR※2, 3を有する再発又は転移性の結腸・直腸癌を対象にした海外第Ⅱ相試験(CA209142)における奏効率(ORR)※4は、31.1%(23/74例:95%信頼区間[20.8, 42.9]※5)でした。(海外データ)1)
※1:高頻度マイクロサテライト不安定性
※2:ミスマッチ修復機能欠損
※3:本邦では、オプジーボ適応外
※4:RECISTガイドライン1.1版に基づく医師判定によるCR及びPRの割合
※5:Clopper-Pearson法
1)小野薬品工業 : 海外第Ⅱ相(CA209142)試験成績(社内資料) 承認時評価資料
【目的】
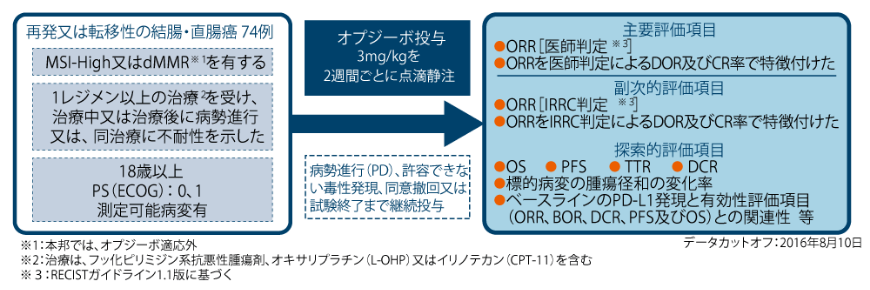
MSI-High又はミスマッチ修復機能欠損(dMMR)※を有し、フッ化ピリミジン系抗悪性腫瘍剤を含む化学療法の施行中もしくは施行後に進行した、又は同療法に不耐性を示した再発又は転移性の結腸・直腸癌に対するオプジーボの有効性及び安全性について検討する。
【試験デザイン】
多施設共同非盲検非対照第Ⅱ相試験
【対象】
MSI-High又はdMMRを有し、フッ化ピリミジン系抗悪性腫瘍剤を含む化学療法の施行中もしくは施行後に進行した、又は同療法に不耐性を示した再発又は転移性の結腸・直腸癌患者74例
【投与方法】
オプジーボ3mg/kgを2週間間隔で60分かけて点滴静注した。
【評価項目】
有効性
[主要評価項目]
奏効率(ORR)[RECISTガイドライン1.1版に基づく医師判定]、ORRを医師判定による奏効期間(DOR)及び完全奏効(CR)率で特徴付けた。
[副次的評価項目]
ORR[RECISTガイドライン1.1版に基づく独立画像判定委員会(IRRC)判定]、ORRをIRRC判定によるDOR及びCR率で特徴付けた。
[探索的評価項目]
全生存期間(OS)、無増悪生存期間(PFS)、奏効に至るまでの期間(TTR)、標的病変の腫瘍径和の変化率、病勢制御率(DCR)、ベースラインのPD-L1発現と有効性評価項目(ORR、BOR、DCR、PFS及びOS)との関連性等
安全性
有害事象、臨床検査値等
【解析計画】
有効性
[主要評価項目]
医師判定による奏効率(ORR)及びその両側95%信頼区間はClopper-Pearson法により算出した。ORRは奏効期間(DOR)及びCR率により特徴付けることとした。最良総合効果(BOR)は、RECISTガイドライン1.1版を用いて試験実施施設の医師が評価し、BORがCR又はPRと確定したMSI-Highの症例のDORをKaplan-Meier法を用いて推定した。DORの中央値及びその両側95%信頼区間は二重対数変換法に基づいて算出した。
[副次的評価項目]
IRRCが判定したORRも主要評価項目と同様に評価し、上述と同様にIRRCの判定に基づくDOR及びCR率により特徴付けることとした。
[探索的評価項目]
全生存期間(OS)及び無増悪生存期間(PFS)は、Kaplan-Meier法を用いて推定し、中央値及びその両側95%信頼区間を二重対数変換法に基づいて算出した。また、生存率及び無増悪生存率の集計時点は、6ヵ月、12ヵ月、18ヵ月、24ヵ月、36ヵ月、48ヵ月、60ヵ月時点(無増悪生存率は3ヵ月、9ヵ月時点も含む)とした。奏効に至るまでの期間(TTR)は、Kaplan-Meier法を用いて解析した。病勢制御率(DCR)及びその両側95%信頼区間はClopper-Pearson法を用いて算出した。標的病変の腫瘍径和の変化率は、症例ごとの推移図を作成した。PD-L1発現状況別にBOR、ORR及びDCRを評価した。ORR及びDCRに対して、割合及びその95%信頼区間はClopper-Pearson法を用いて算出した。
[サブグループ解析]
解析計画の有効性で設定された評価項目(ORR、BOR、DOR、TTR、DCR、PFS及びOS)において規定されたフッ化ピリミジン系抗悪性腫瘍剤(フルオロウラシル、カペシタビン)、オキサリプラチン及びイリノテカン(以下、5-FU/L-OHP/CPT-11)の治療歴を有する患者集団を対象としたサブグループ解析を行った。また、事前規定された年齢、性別、ECOGPS、地域、人種、BRAF/KRAS変異状況、リンチ症候群、初回診断から初回投与までの期間、最後のレジメン終了から治療開始までの期間、前治療のレジメン数を層別因子とし、ORRのサブグループ解析を行った。
※:本邦では、オプジーボ適応外
試験デザイン
主な選択基準及び除外基準
主な選択基準
(1) ECOG PSが0-1の18歳以上の成人男女
(2) 組織学的に再発又は転移性の結腸・直腸癌であることが確認されている
(3) 現地の規制に従って認定された検査機関でMSI-High又はdMMRが検出されている
(4) 治療歴
再発又は転移性の結腸・直腸癌の場合は以下の基準を満たしていること
転移病巣に対して、少なくとも以下の薬剤を含む1レジメン以上の治療を受け、治療中もしくは治療後に進行した、又は同治療に不耐性を示した患者
(5) フッ化ピリミジン系抗悪性腫瘍剤
(6) オキサリプラチン(L-OHP)又はイリノテカン(CPT-11)
術後補助療法としてL-OHPによる治療を受けた患者の場合、L-OHPを組み入れに必要な治療歴として治療回数に含めるには、術後補助療法の施行中又は施行後6ヵ月以内に進行が認められていることが必要
(7) 症状緩和のための放射線療法は、治験薬投与前2週間以内に完了していること
(8) スクリーニング期に実施する(治験薬投与前14日までの検査)臨床検査値が以下の基準を満たしていること
(9) 白血球≧2,000/μL ・好中球≧1,500/μL ・血小板≧100,000/μL ・ヘモグロビン≧9.0g/dL
(10) 血清クレアチニンが正常値上限の1.5倍以下又はCockcroft-Gault式によるクレアチニンクリアランスが40mL/分以上
(11) アスパラギン酸アミノトランスフェラーゼ又はアラニンアミノトランスフェラーゼが正常値上限の3倍以下
主な除外基準
(1) 症状を伴う脳転移もしくは軟膜・髄膜転移が認められる患者
(2) 抗PD-1抗体、抗PD-L1抗体、抗PD-L2抗体、抗CTLA-4抗体、又はT細胞共刺激経路あるいは免疫チェックポイント経路に対する抗体又はそれらの経路に特異的に作用する薬剤による治療歴のある患者
(3) 皮膚の基底細胞癌、皮膚の扁平上皮細胞癌、表在性膀胱癌などの限局的な治癒可能な癌を除いて、過去3年以内に活動性の悪性腫瘍が認められた患者
(4) 活動性、既知の自己免疫疾患もしくは自己免疫疾患の疑いのある患者(尋常性白斑、1型糖尿病、ホルモン補充療法のみが必要な自己免疫性の甲状腺機能低下症、全身治療を必要としない又は外的要因がなければ再燃するとは考えられない乾癬患者は組み入れ可能)
(5) 治験薬の投与前14日以内に副腎皮質ステロイド(10mg/日を超えるプレドニゾン等価量)もしくはその他の免疫抑制剤の全身投与を必要とする症状のある患者
投与方法
患者背景(全症例、5-FU/L-OHP/CPT-11の治療歴を有する集団)
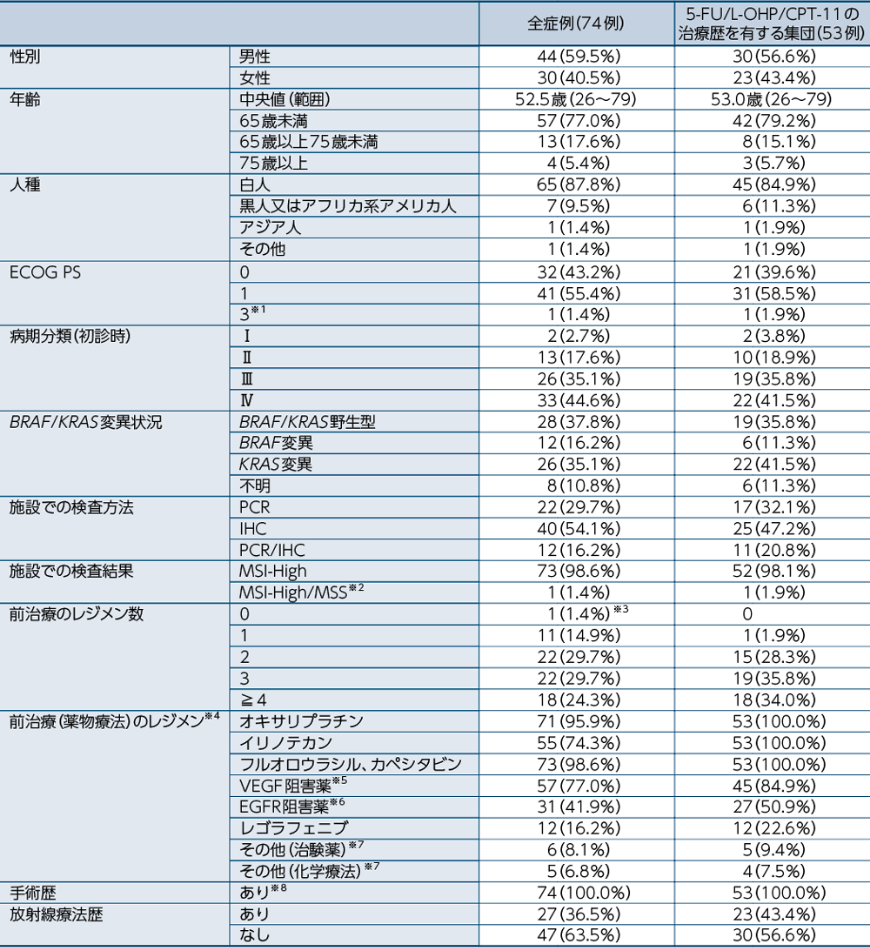
※1:スクリーニング時はPS 1であった
※2:施設検査では、MSI-Highとみなされた
※3:化学療法を拒否し、試験に登録した症例
※4:複数の治療を受けた症例を含む
※5:ベバシズマブ、アフリベルセプト、ラムシルマブ
※6:セツキシマブ、パニツムマブ
※7:本邦未承認薬を含む ※8:腫瘍生検を含む
有効性(全症例)
奏効率(ORR)[医師判定]〔主要評価項目〕
奏効率(ORR)は31.1%(23/74例)、95%信頼区間は[20.8, 42.9]※1でした。
※1:Clopper-Pearson法
最良総合効果(BOR)[医師判定]
最良総合効果(BOR)は下表の通りでした。

例数(%) 解析対象:評価可能症例 [95%信頼区間]はClopper-Pearson法に基づく
※2:医師判定による最良総合効果はSDであったが、治験薬投与開始から12週間持続しなかった症例が1例含まれる。
この症例はDCR[CR+PR+SD(≧12週)]の算出には含まれなかった。
奏効期間(DOR)[医師判定]
奏効が認められた23例において、奏効期間(DOR)の中央値は未達(95%信頼区間[6.83, −]※3)でした。
※3:Kaplan-Meier法
奏効率(ORR)[IRRC判定] 〔副次的評価項目〕
奏効率(ORR)は27.0%(20/74例)、95%信頼区間は[17.4, 38.6]※4でした。
※4:Clopper-Pearson法
最良総合効果(BOR)[IRRC判定]
最良総合効果(BOR)は下表の通りでした。

例数(%) 解析対象:評価可能症例 [95%信頼区間]はClopper-Pearson法に基づく
奏効期間(DOR)[IRRC判定]
奏効が認められた20例において、奏効期間(DOR)の中央値は未達でした。
奏効に至るまでの期間(TTR)及び病勢制御率(DCR)[医師判定/IRRC判定] 〔探索的評価項目〕
奏効に至るまでの期間(TTR)及び病勢制御率(DCR)は下表の通りでした。

※5:DCR=CR+PR+SD(≧12週)
※6:Clopper-Pearson法
全生存期間(OS) 〔探索的評価項目〕
全生存期間(OS)の中央値は未達(95%信頼区間[17.12, - ]※)でした。
OSの追跡期間中央値は、7.41ヵ月(範囲:0.3〜25.3ヵ月)でした。
OSのKaplan-Meier曲線(全症例)
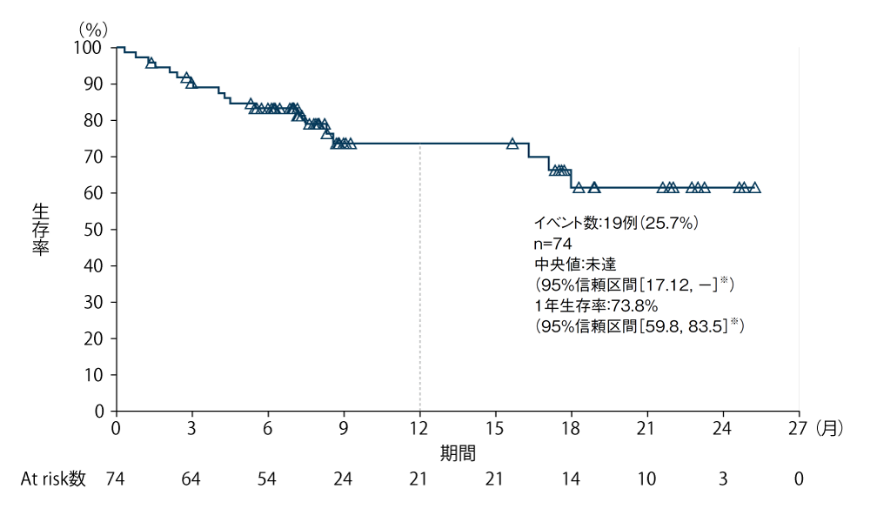
※:Kaplan-Meier法
無増悪生存期間(PFS)[医師判定] 〔探索的評価項目〕
医師判定による無増悪生存期間(PFS)の中央値は9.59ヵ月(95%信頼区間[4.30, - ]※)でした。
PFSのKaplan-Meier曲線(全症例)
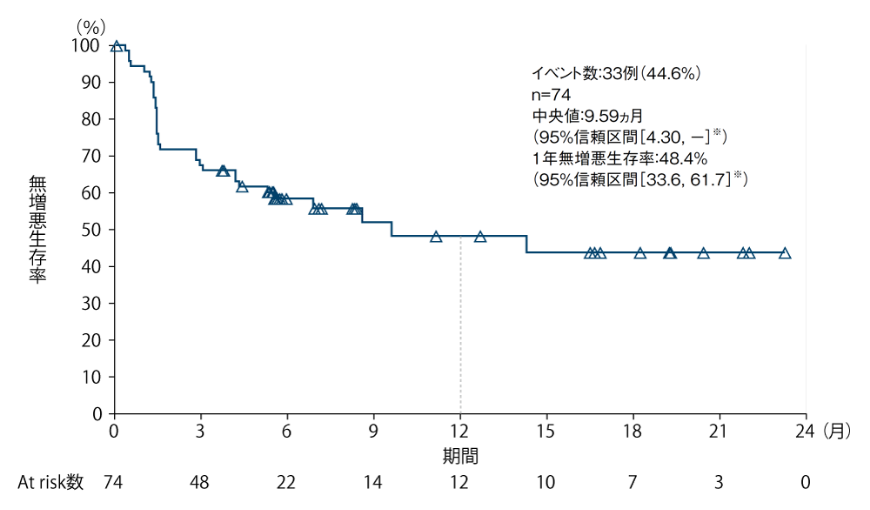
※:Kaplan-Meier法
標的病変の腫瘍径和の変化率[医師判定] 〔探索的評価項目〕
腫瘍径和の変化率は下図の通りでした。
標的病変の腫瘍径和の変化率
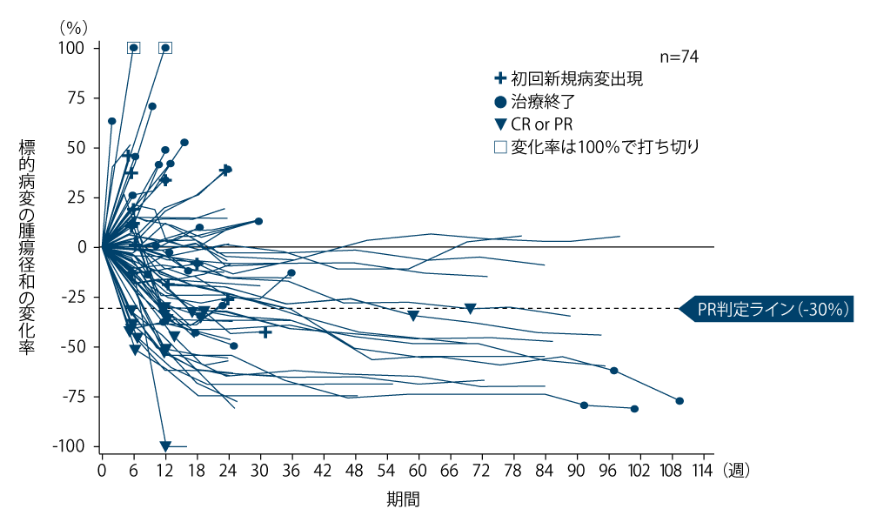
有効性(5-FU/L-OHP/CPT-11の治療歴を有する集団)
奏効率(ORR)[医師判定]〔主要評価項目・サブグループ解析〕/[IRRC判定]〔副次的評価項目・サブグループ解析〕
最良総合効果(BOR)[医師判定/IRRC判定]〔サブグループ解析〕
5-FU/L-OHP/CPT-11の治療歴を有する集団において医師判定による奏効率(ORR)は26.4%(14/53例)、95%信頼区間は[15.3, 40.3]※1、IRRC判定によるORRは22.6%(12/53例)、95%信頼区間は[12.3, 36.2]※1でした。
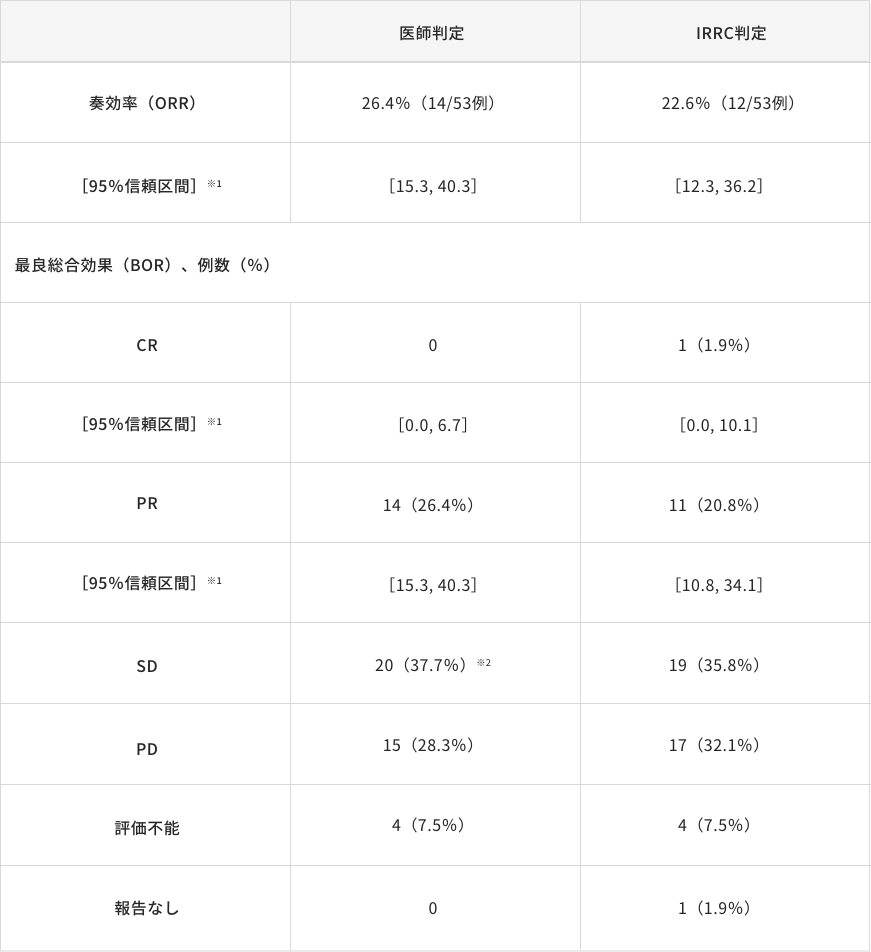
解析対象:評価可能症例 ※1:Clopper-Pearson法 ※2:医師判定による最良総合効果はSDであったが、治験薬投与開始から12週間持続しなかった
症例が1例含まれる。この症例はDCR[CR+PR+SD(≧12週)]の算出には含まれなかった
奏効期間(DOR)[医師判定/IRRC判定]〔サブグループ解析〕
5-FU/L-OHP/CPT-11の治療歴を有する集団における奏効期間(DOR)は、下表の通りでした。

奏効に至るまでの期間(TTR)及び病勢制御率(DCR) [ 医師判定/IRRC判定]〔探索的評価項目・サブグループ解析〕
5-FU/L-OHP/CPT-11の治療歴を有する集団において、奏効に至るまでの期間(TTR)及び病勢制御率(DCR)は下表の通りでした。

※3:DCR=CR+PR+SD(≧12週)
※4:Clopper-Pearson法
全生存期間(OS) 〔探索的評価項目・サブグループ解析〕
5-FU/L-OHP/CPT-11の治療歴を有する集団において、全生存期間(OS)の中央値は、未達(95%信頼区間[16.33, -]※)でした。
OSの追跡期間中央値は、7.23ヵ月(範囲:0.3〜24.8ヵ月)でした。
OSのKaplan-Meier曲線(5-FU/L-OHP/CPT-11の治療歴を有する集団)
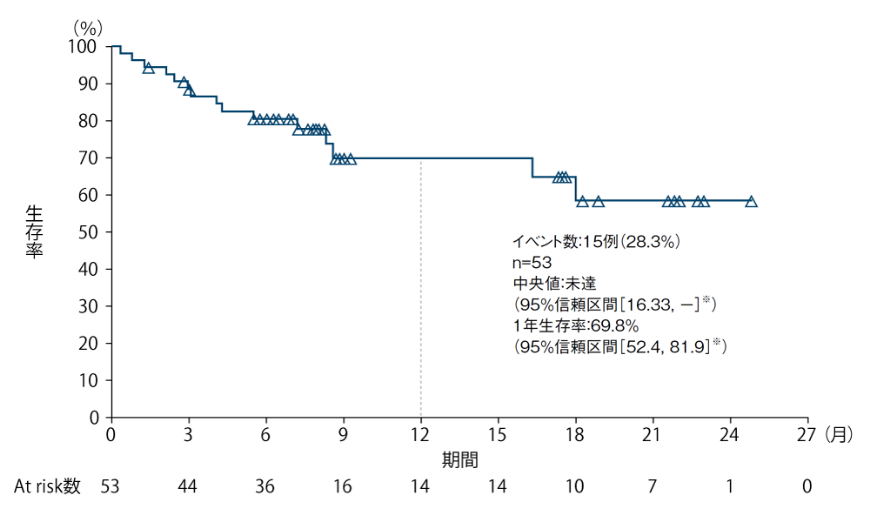
※:Kaplan-Meier法
無増悪生存期間(PFS)[医師判定]〔探索的評価項目・サブグループ解析〕
5-FU/L-OHP/CPT-11の治療歴を有する集団において、医師判定による無増悪生存期間(PFS)の中央値は、8.57ヵ月(95%信頼区間[1.54, - ]※)でした。
PFSのKaplan-Meier曲線(5-FU/L-OHP/CPT-11の治療歴を有する集団)
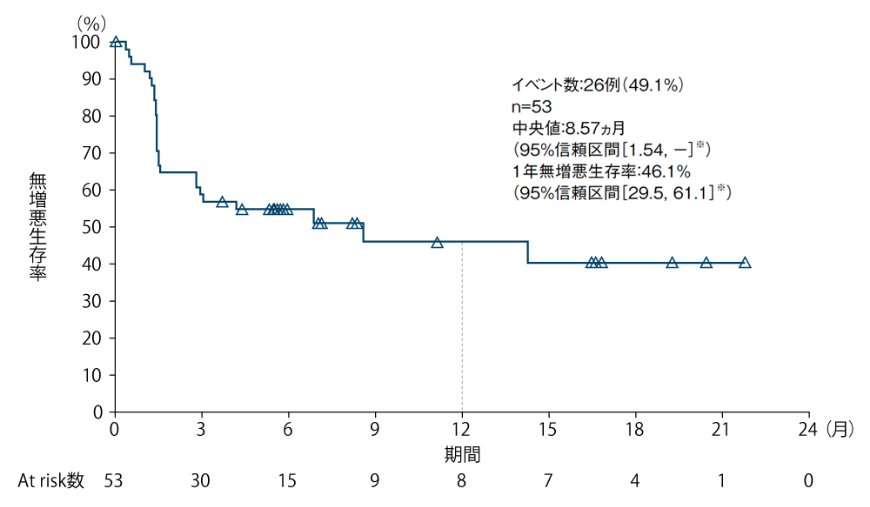
※:Kaplan-Meier法
安全性(全症例)
臨床検査値異常変動を含む副作用は68.9%(51/74例)に認められました。
主な副作用(10%以上)は、疲労23.0%(17例)、下痢21.6%(16例)、そう痒症13.5%(10例)、リパーゼ増加12.2%(9例)及び発疹10.8%(8例)でした。
重篤な副作用は10.8%(8例)に認められ、大腸炎、下痢、胃炎、口内炎、疼痛、突然死、副腎機能不全、アラニンアミノトランスフェラーゼ増加及び急性腎障害各1.4%(1例)でした。
投与中止に至った副作用は5.4%(4例)に認められ、大腸炎、口内炎、アラニンアミノトランスフェラーゼ増加及び急性腎障害各1.4%(1例)でした。
死亡に至った副作用として突然死(1例)※が報告されました。
※:剖検の結果、死因は原因不明とされています。
5%以上に発現した副作用一覧
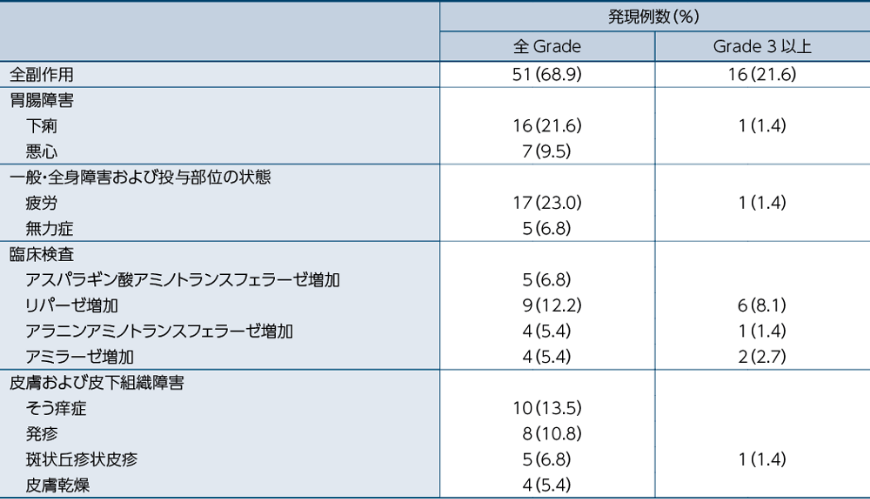
医師から報告された有害事象名は、MedDRA ver 19.0Jを用いて読み替え、CTCAEv4.0を用いて評価しました。因果関係は、「関連あり」、「関連なし」の2段階で評価され、「関連あり」と判定された場合に、副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。発現頻度は、治験薬の初回投与から最終投与後30日までに発現した事象を対象に集計しました。
留意すべき副作用一覧
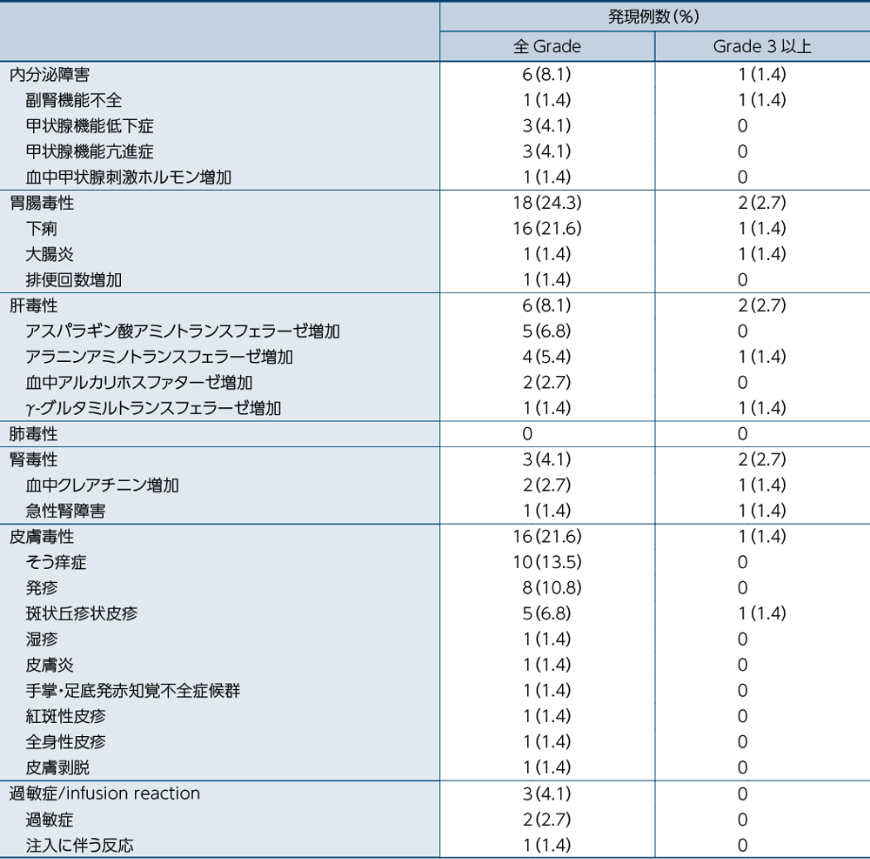
医師から報告された有害事象名は、MedDRA ver 19.0Jを用いて読み替え、CTCAEv4.0を用いて評価しました。因果関係は、「関連あり」、「関連なし」の2段階で評価され、「関連あり」と判定された場合に、副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。発現頻度は、治験薬の初回投与から最終投与後30日までに発現した事象を対象に集計しました。
【4.効能又は効果(一部抜粋)】
がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌
【5.効能又は効果に関連する注意(一部抜粋)】
〈がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌〉
5.7 十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された患者に投与すること。検査にあたっては、承認された体外診断薬を用いること。
【17. 臨床成績 17.1.17 海外第Ⅱ相試験(CA209142試験)(一部抜粋)】
本試験において、dMMR及びMSI-Highの判定には、それぞれIHC法及びPCR法が用いられ、これらとの同等性が確認された株式会社ファルコバイオシステムズのPCR法「MSI検査キット(FALCO)」がMSI-Highの判定を目的とするコンパニオン診断薬として製造販売承認されている。
【6.用法及び用量(一部抜粋)】
〈がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔で点滴静注する。
【7.用法及び用量に関連する注意(一部抜粋)】〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。

















