CheckMate 577試験(国際共同第Ⅲ相試験)概要
術前補助療法および完全切除後の食道癌または食道胃接合部癌に対する
オプジーボの有効性を検討した国際共同第Ⅲ相試験1,2)
- 小野薬品工業:国際共同第Ⅲ相
(ONO-4538-43/CA209577)試験成績(社内資料) 承認時評価資料 - Kelly RJ, et al. N Engl J Med. 384: 1191-1203, 2021. [利益相反]本試験は、Bristol-Myers Squibbおよび小野薬品工業の支援をうけて実施された。
試験概要
試験デザイン
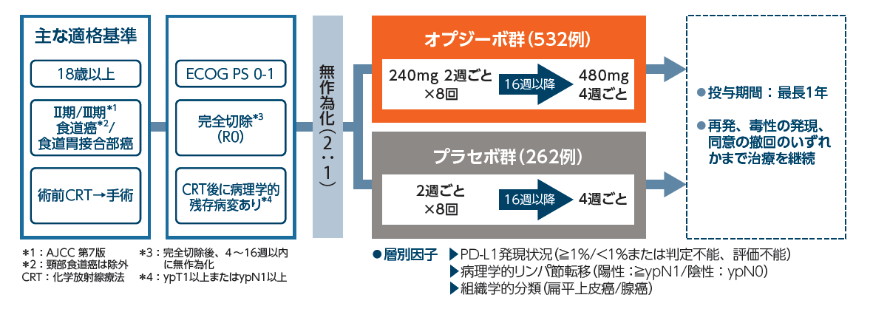
【目的】
術前補助療法および完全切除後の食道癌または食道胃接合部癌患者を対象に、オプジーボ群のプラセボ群に対する優越性を検証し、安全性を検討する。
【試験デザイン】
国際共同プラセボ対照二重盲検無作為化比較第Ⅲ相試験[優越性試験]
【対象】
術前補助療法としての化学放射線療法(CRT)で病理学的完全奏効が得られず(non-pCR)、かつ、術前CRT後の手術で完全切除(R0)された食道癌または食道胃接合部癌患者794例※1
[オプジーボ群:532例(日本人:50例)、プラセボ群:262例(日本人:13例)]
※1:術前補助療法を実施しなかった症例が2例含まれる(オプジーボ群:1例、プラセボ群:1例)
【投与方法】
オプジーボ群:オプジーボ240mgを2週間間隔で16週間投与し(サイクル1~8)、その後17週目(8回目の投与後2週間)からはオプジーボ480mgを4週間間隔で投与した(サイクル9~17)。合計投与期間は最長1年間とした。
プラセボ群:オプジーボ群と同じ用法でプラセボを投与した。
【評価項目】
有効性
- 主要評価項目:無病生存期間(DFS)
- 副次的評価項目:全生存期間(OS)および全生存率※2
- 探索的評価項目: PD-L1発現状況別の無病生存期間(DFS)
- 無遠隔転移生存期間(DMFS)
- 二次治療までの無増悪生存期間(PFS2)※3
- 健康関連QOLの評価
※2:本承認時(中間報告)には含まれない
※3:無作為化から1回目の後治療後の病勢進行、2回目の後治療開始または死亡までの期間
安全性
有害事象、臨床検査値等
【解析計画】
有効性
主要評価項目: 無病生存期間(DFS)について、有意水準0.036(両側)で優越性検定を行った。Web自動応答システム(IWRS)に記録された3つの割付因子(PD-L1発現状況、病理学的リンパ節転移、組織学的分類)によって層別化した両側log-rank検定により、投与群間のDFSを比較した。投与群を共変量とした層別Cox比例ハザードモデルにより、DFSのハザード比と96.4%信頼区間を推定した。Kaplan-Meier法により各投与群のDFSを推定し、中央値を算出し、生存関数の二重対数変換により中央値の95%信頼区間を算出した。各投与群の6ヵ月時点の無病生存率をKaplan-Meier法を用いて推定し、対応する信頼区間は分散算出のためのGreenwoodの式および生存関数の二重対数変換を用いて算出した。
探索的評価項目: 無遠隔転移生存期間(DMFS)、二次治療までの無増悪生存期間(PFS2)について、ハザード比およびそれぞれに対応する両側95%信頼区間を、投与群を共変量とした層別Cox比例ハザードモデルを用いて推定した。上記3つの割付因子により層別化し、解析を行った。各投与群のDMFSおよびPFS2をKaplan-Meier法を用いて推定し、生存期間の中央値と6ヵ月時点の無遠隔転移生存率および無増悪生存率はKaplan-Meier推定値を用いて算出し、生存関数の二重対数変換により中央値の95%信頼区間を算出した。DFSについて、投与群を共変量とした非層別Cox比例ハザードモデルを用いて、PD-L1発現状況別にオプジーボ群のプラセボ群に対するハザード比と95%信頼区間を推定し、投与群ごとにKaplan-Meier曲線を示してDFS中央値と95%信頼区間を推定した。健康関連QOLについて、FACT-E、EQ-5D VAS、EQ-5D Utility Index Scoreを用いて評価し、ベースラインからの変化とそれぞれの最小二乗平均値および95%信頼区間について、mixed-effects models for repeated measures(MMRM)解析を行った。
サブグループ解析: 年齢、性別、人種、ECOG PS、病期、病変部位、組織学的分類、病理学的リンパ節転移、腫瘍の病理学的分類、組織学的Grade分類、完全切除から無作為化までの期間、HER2遺伝子、PD-L1発現状況を因子として、DFSの部分集団解析を実施した。また、投与群を共変量とした非層別Cox比例ハザードモデルを用いて、オプジーボ群のプラセボ群に対するハザード比および95%信頼区間を算出し、forest plotを作成した。
患者背景

※1:AJCC 第7版による分類 ※2:症例報告書(CRF)の情報 ※3:登録時
有効性
無病生存期間(DFS)[主要評価項目]
●DFS(医師判定)のKaplan-Meier曲線
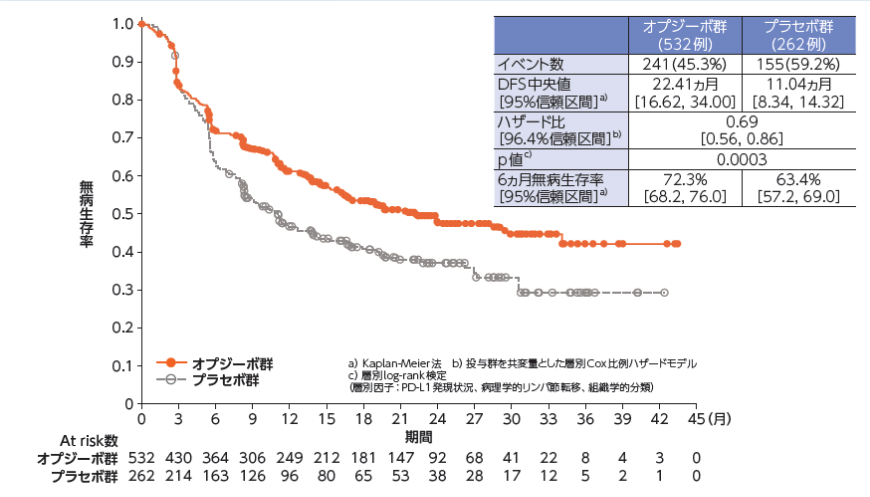
DFSについて、オプジーボ群のプラセボ群に対する優越性が検証されました(p=0.0003、有意水準0.036、層別log-rank検定)1)。
1)小野薬品工業:国際共同第Ⅲ相(ONO-4538-43/CA209577)試験成績(社内資料) 承認時評価資料
組織学的分類別の DFS[主要評価項目・サブグループ解析]2)
●組織学的分類別のDFSのKaplan-Meier曲線
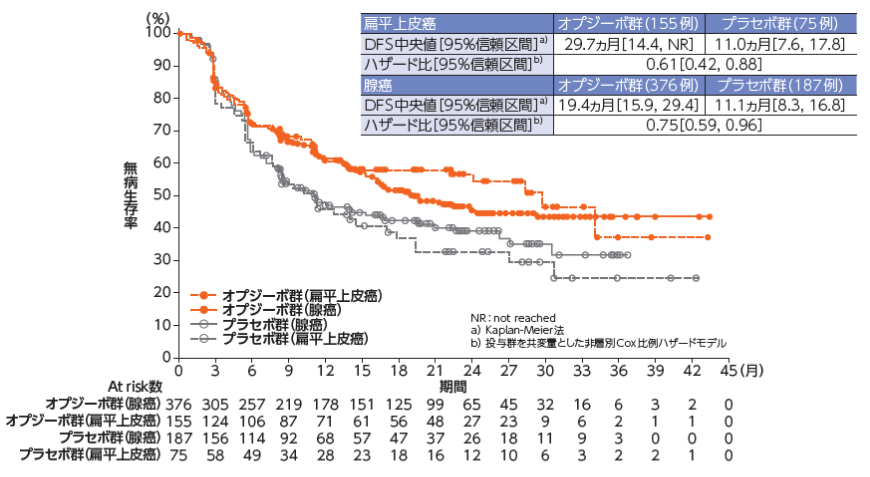
2)Kelly RJ, et al. N Engl J Med. 384: 1191-1203, 2021.
DFS[主要評価項目・サブグループ解析]
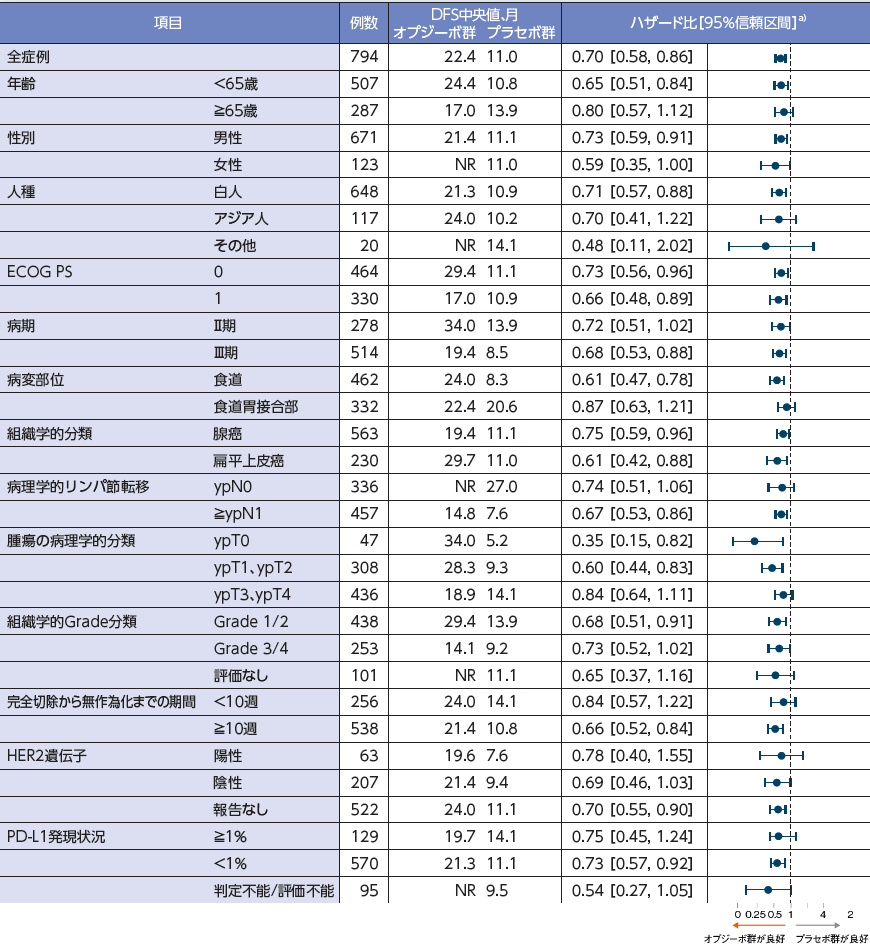
NR:not reached
a)投与群を共変量とした非層別Cox比例ハザードモデル
PD-L1発現1%以上におけるDFS中央値は、オプジーボ群19.7ヵ月、プラセボ群14.1ヵ月、PD-L1発現1%未満では、オプジーボ群21.3ヵ月、プラセボ群11.1ヵ月でした2)。
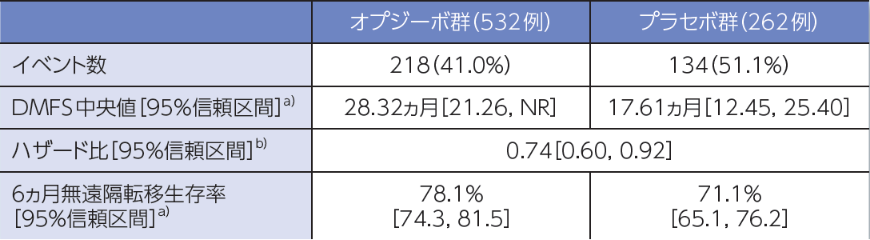
無遠隔転移生存期間(DMFS)[探索的評価項目]
●DMFS(医師判定)のKaplan-Meier曲線
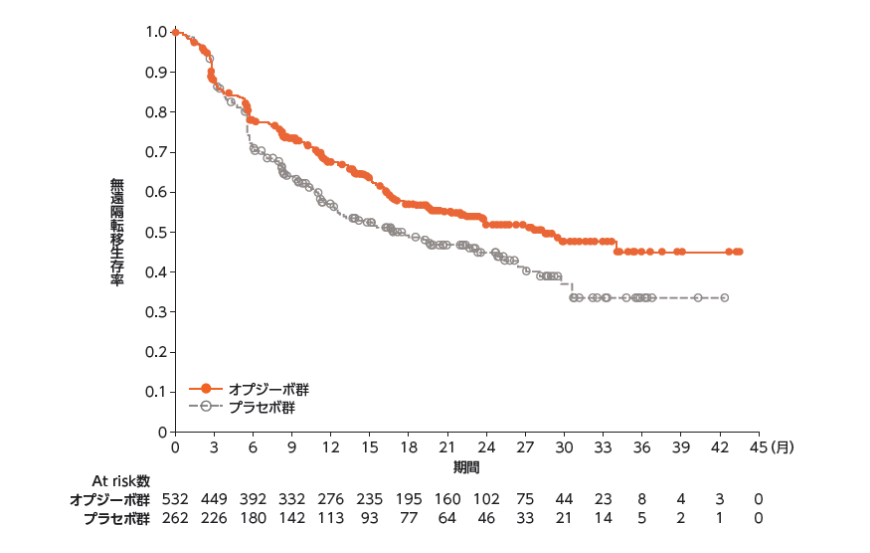
DMFS:無作為化から最初に遠隔転移が認められた日、または死亡日(死因は問わない)のいずれか早い時点までの期間
NR:not reached
a) Kaplan-Meier法 b) 投与群を共変量とした層別Cox比例ハザードモデル
(層別因子:PD-L1発現状況、病理学的リンパ節転移、組織学的分類)
DMFS中央値は、オプジーボ群28.32ヵ月、プラセボ群17.61ヵ月でした1)。
1)小野薬品工業:国際共同第Ⅲ相(ONO-4538-43/CA209577)試験成績(社内資料) 承認時評価資料
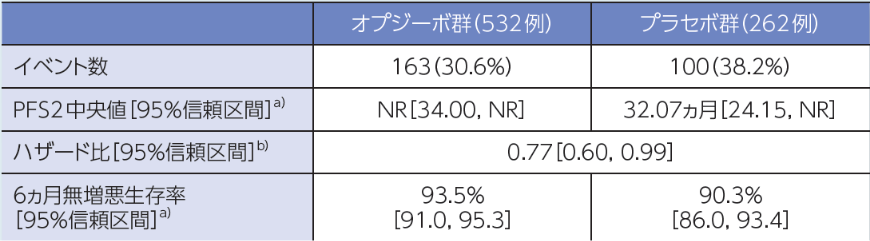
二次治療までの無増悪生存期間(PFS2)[探索的評価項目]
●PFS2(医師判定)のKaplan-Meier曲線
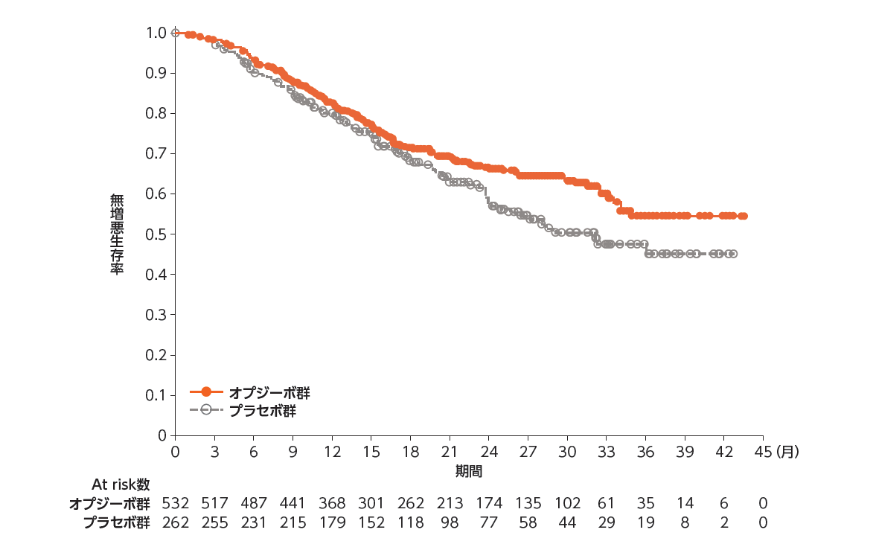
PFS2:無作為化から1回目の後治療後の病勢進行、2回目の後治療開始または死亡までの期間
NR:not reached
a) Kaplan-Meier法 b) 投与群を共変量とした層別Cox比例ハザードモデル
(層別因子:PD-L1発現状況、病理学的リンパ節転移、組織学的分類)
PFS2中央値は、オプジーボ群未達、プラセボ群32.07ヵ月でした1)。
1)小野薬品工業:国際共同第Ⅲ相(ONO-4538-43/CA209577)試験成績(社内資料) 承認時評価資料
安全性
副作用
副作用は、オプジーボ群で70.7%(376例)、プラセボ群で45.8%(119例)に認められました。オプジーボ群で発現率が10%以上の副作用は、疲労16.9%(90例)、下痢16.5%(88例)、そう痒症10.0%(53例)でした。プラセボ群で発現率が10%以上の副作用は、下痢15.0%(39例)、疲労11.2%(29例)でした。
重篤な副作用は、オプジーボ群で7.5%(40例)、プラセボ群で2.7%(7例)に認められました。オプジーボ群で2例以上に認められた重篤な副作用は、肺臓炎1.1%(6例)、心筋炎0.6%(3例)、肺炎0.4%(2例)、下痢0.4%(2例)、敗血症0.4%(2例)、大腸炎0.4%(2例)、間質性肺疾患0.4%(2例)でした。プラセボ群で2例以上に認められた重篤な副作用は、肺臓炎0.8%(2例)でした。
投与中止に至った副作用は、オプジーボ群で9.0%(48例)、プラセボ群で3.1%(8例)に認められました。オプジーボ群で2例以上に認められた投与中止に至った副作用は、肺臓炎1.9%(10例)、心筋炎0.6%(3例)、発疹0.6%(3例)、アラニンアミノトランスフェラーゼ増加0.4%(2例)、自己免疫性肝炎0.4%(2例)、肺炎0.4%(2例)、そう痒症0.4%(2例)、乾癬0.4%(2例)、敗血症0.4%(2例)でした。プラセボ群で2例以上に認められた投与中止に至った副作用は、肺臓炎0.8%(2例)でした。
投与期間中または追跡期間中(治験薬最終投与後30日以内)に死亡に至った有害事象は、オプジーボ群で13例(悪性新生物進行7例、心停止1例、自殺既遂1例、悪性新生物進行/頭蓋内出血1例、心筋梗塞1例、誤嚥性肺炎1例、中枢神経系転移1例)、プラセボ群で11例(悪性新生物進行6例、気胸1例、再発癌1例、亜急性心内膜炎1例、全身健康状態悪化1例、胆管閉塞1例)に認められました。これらの死亡について、いずれも治験薬との因果関係は否定されました。
1)小野薬品工業:国際共同第Ⅲ相(ONO-4538-43/CA209577)試験成績(社内資料) 承認時評価資料
留意すべき副作用
●いずれかの群で1%以上に発現した留意すべき副作用
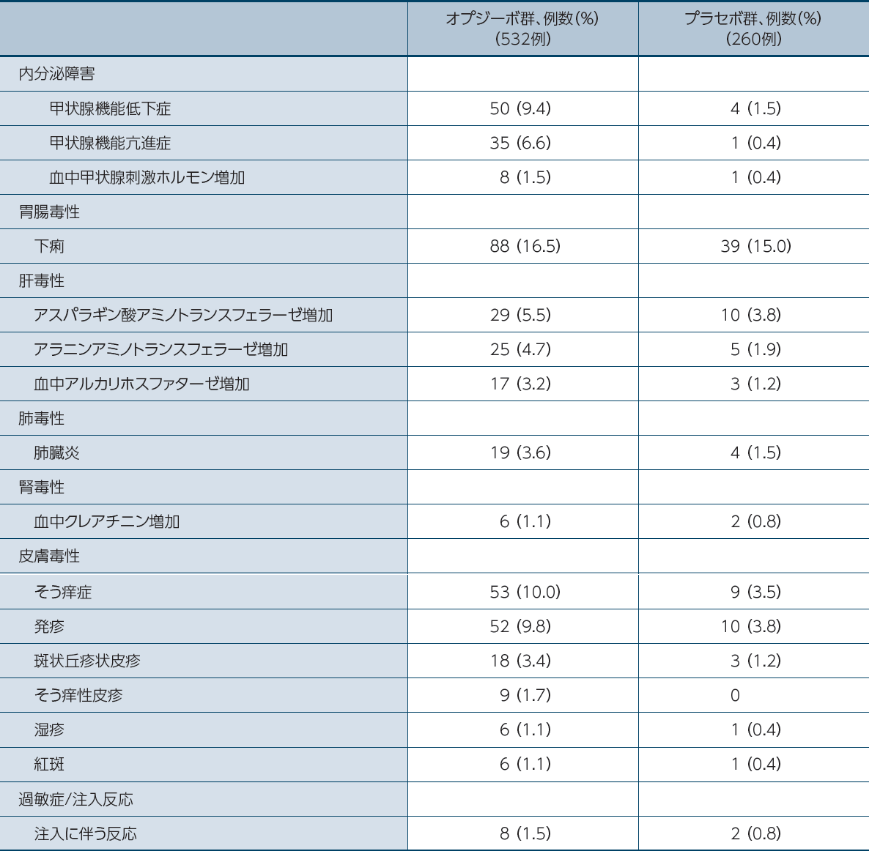
オプジーボ群で10%以上に発現した留意すべき副作用は、下痢、そう痒症でした1)。
1)小野薬品工業:国際共同第Ⅲ相(ONO-4538-43/CA209577)試験成績(社内資料) 承認時評価資料
その他
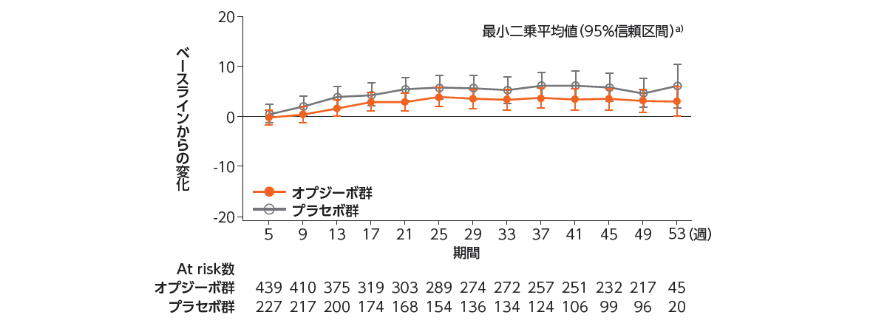
健康関連QOLの評価[探索的評価項目][参考情報]
●FACT-E(参考情報)
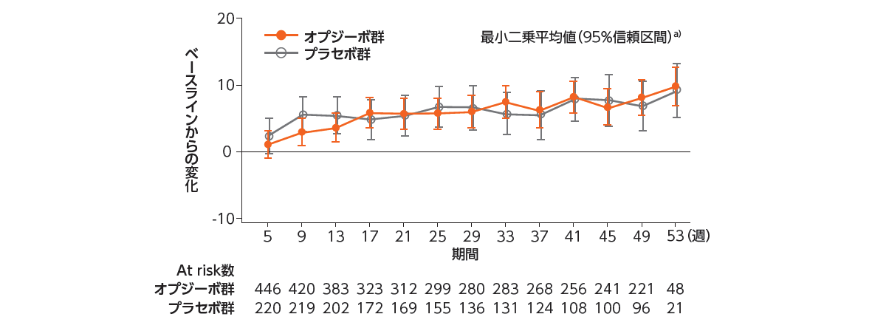
●EQ-5D VAS(参考情報)
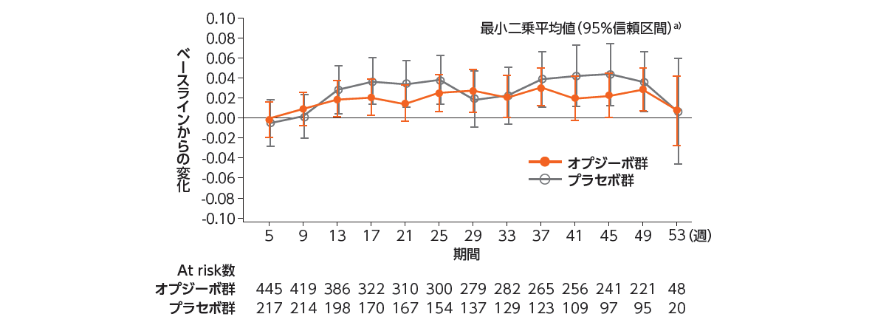
●EQ-5D Utility Index Score(参考情報)
FACT-E(Functional Assessment of Cancer
Therapy-Esophageal):核となる質問票(FACT-General)に食道癌用の尺度(ECS)を追加した食道癌特異的な質問票
EQ(EuroQol):5項目法(5D Utility Index Score)と視覚評価法(VAS:Visual Analogue Scale)からなる質問票
a)MMRM解析
FACT-EおよびEQ-5Dを用いて健康関連QOLを評価した結果は、以下の通りでした1,2)。
1)小野薬品工業:国際共同第Ⅲ相(ONO-4538-43/CA209577)試験成績(社内資料) 承認時評価資料
2)Kelly RJ, et al. N Engl J Med. 384: 1191-1203, 2021. Supplementary Appendix
4. 効能又は効果(一部抜粋)
がん化学療法後に増悪した根治切除不能な進行・再発の食道癌、食道癌における術後補助療法
5. 効能又は効果に関連する注意(一部抜粋)
〈がん化学療法後に増悪した根治切除不能な進行・再発の食道癌〉
5.17 本剤の一次治療における有効性及び安全性は確立していない。
5.18 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.25参照]
〈食道癌における術後補助療法〉
5.19 術前補助療法により病理学的完全奏効(pCR)が認められなかった患者に投与すること。
5.20 本剤の術前補助療法における有効性及び安全性は確立していない。
5.21 臨床試験に組み入れられた患者の前治療歴、pCRの定義等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
[17.1.26参照]
6. 用法及び用量(一部抜粋)
〈がん化学療法後に増悪した根治切除不能な進行・再発の食道癌、食道癌における術後補助療法〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。ただし、食道癌における術後補助療法の場合は、投与期間は12ヵ月間までとする。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈がん化学療法後に増悪した根治切除不能な進行・再発の食道癌〉
7.13 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
〈食道癌における術後補助療法〉
7.14 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。

















