CheckMate 648 試験(国際共同第Ⅲ相試験)概要
化学療法未治療の根治切除不能な進行・再発の食道癌に対するオプジーボ・ヤーボイ併用療法およびオプジーボ・化学療法併用療法の有効性・安全性を検討した国際共同第Ⅲ相試験1,2)
- 小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
- Doki Y. et al.: N. Engl. J. Med., 386: 449, 2022.
[利益相反]本試験は、Bristol-Myers Squibbおよび小野薬品工業の支援をうけて実施された。
試験概要
試験デザイン
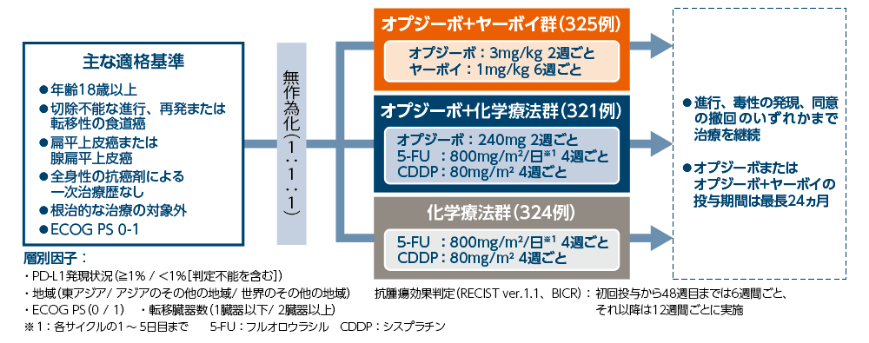
試験概要
【目的】
化学療法未治療の根治切除不能な進行・再発の食道癌※2を対象に、オプジーボ+ヤーボイ群、またはオプジーボ+化学療法※3群の化学療法※3群に対する優越性を検証し、安全性を検討する。
※2:病理組織学的検査において扁平上皮癌又は腺扁平上皮癌(主に扁平上皮癌が分化)と診断され、大動脈、気管等への明らかな浸潤を認めない患者が対象
※3:フルオロウラシル(5-FU)およびシスプラチン(CDDP)を含む化学療法
【試験デザイン】
国際共同実薬対照非盲検無作為化比較第Ⅲ相試験[優越性試験]
【対象】
化学療法未治療の根治切除不能な進行・再発の食道癌※2患者970例
[オプジーボ+ヤーボイ群:325例(日本人:131例)、オプジーボ+化学療法群:321例(日本人:126例)、化学療法群:324例(日本人:137例)]
【投与方法】
オプジーボ+ヤーボイ群:オプジーボ3mg/kgを2週間間隔、ヤーボイ1mg/kgを6週間間隔で投与した。
オプジーボ+化学療法群: オプジーボ240mgを2週間間隔、フルオロウラシル(5-FU)※4800mg/m2/日(各サイクルの1~ 5日目まで)を4週間間隔、シスプラチン(CDDP)※5 80mg/m2を4週間間隔で投与した。
化学療法群: 5-FU 800mg/m2/日(各サイクルの1~ 5日目まで)を4週間間隔、CDDP 80mg/m2を4週間間隔で投与した。
※4:本邦におけるフルオロウラシルの用法・用量(食道癌)は、「他の抗悪性腫瘍剤との併用療法において、通常、成人にはフルオロウラシルとして1日1000mg/m2(体表面積)までを、4~ 5日間連日で持続点滴する。投与を繰り返す場合には少なくとも3週間以上の間隔をあけて投与する。本剤単独投与の場合には併用投与時に準じる。なお、年齢、患者の状態などにより適宜減量する」。
※5:本邦におけるシスプラチンの用法・用量(食道癌)は、「シスプラチンとして50〜70mg/m2(体表面積)を1日1回投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す」を標準的用法・用量とし、患者の状態により「シスプラチンとして15~20mg/m2(体表面積)を1日1回、5日間連続投与し、少なくとも2週間休薬する。これを1クールとし、投与を繰り返す」を選択する。
評価項目
- 主要評価項目:PD-L1≧1%の症例における全生存期間(OS)、PD-L1≧1%の症例における無増悪生存期間(PFS)※6
- 副次的評価項目:無作為化された全症例におけるOS、無作為化された全症例におけるPFS※6
- PD-L1≧1%の症例および無作為化された全症例における奏効率(ORR)※6
- 探索的評価項目:PD-L1≧1%の症例および無作為化された全症例における奏効期間(DOR)※6
- その他の評価項目:PD-L1≧1%の症例および無作為化された全症例における最良総合効果(BOR)※6
※6:BICR(盲検下独立中央判定)
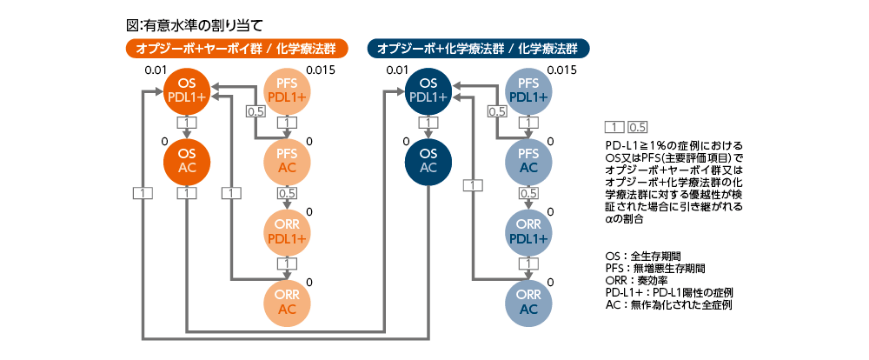
解析計画(一部抜粋)
【有効性の解析】
本試験の主要評価項目はPD-L1≧1%の症例におけるOSおよびPFS※6(RECIST ver.1.1による)とされた。OSについては有効性評価を目的とした1回の中間解析が計画され、化学療法群のPD-L1≧1%の症例において136件のPFSに関するイベントが確認された時点、または最後の症例が登録されてから12ヵ月以上経過した時点のいずれか早い時点でPFSの主要解析およびOSの中間解析を実施することとされた。
複数の評価項目および解析対象集団を設定することに伴う多重性の調整については、主要解析対象とされたPD-L1≧1%の症例のオプジーボ+ヤーボイ群/化学療法群との比較におけるPFSおよびOS、ならびにオプジーボ+化学療法群/化学療法群との比較におけるPFSおよびOSに対してそれぞれ、0.015および0.01、ならびに0.015および0.01の有意水準(両側)を割り当てた上で、Bonferroni法に基づくグラフィカルアプローチ(図)により、試験全体の第一種の過誤確率が両側0.05に制御されるよう調整された。なお、中間解析の実施に伴う第一種の過誤確率の制御には、Lan-DeMets法に基づく O’Brien-Fleming型のα消費関数を用いることとされた。
【主要評価項目】
・PD-L1≧1%の症例におけるOSおよびPFS※6
PD-L1≧1%の症例におけるOSおよびPFSについて、地域、ECOG PS、転移臓器数を層別因子としたlog-rank検定を用い、オプジーボ+化学療法群/化学療法群、オプジーボ+ヤーボイ群/化学療法群間でそれぞれ比較した。OSおよび6ヵ月・12ヵ月時点の生存率、PFSおよび6ヵ月・12ヵ月時点の無増悪生存率をKaplan-Meier法によって推定し、各比較について、割付因子を層別因子、投与群を単一の共変量とする層別Cox比例ハザードモデルにより、ハザード比とその両側100×(1−α)%信頼区間を推定した。
【副次的評価項目】
・無作為化された全症例におけるOSおよびPFS※6
主要評価項目において有意差がみられた場合にのみ検定を行った(階層的検定)。主要評価項目と同じ層別因子およびPD-L1発現状況(≧1%vs<1%[判定不能を含む])で層別化したlog-rank検定により、オプジーボ+化学療法群/化学療法群、オプジーボ+ヤーボイ群/化学療法群間でそれぞれ比較した。OSおよび6ヵ月・12ヵ月時点の生存率、PFSおよび6ヵ月・12ヵ月時点の無増悪生存率をKaplan-Meier法によって推定し、生存関数の二重対数変換により生存期間中央値とその95%信頼区間を算出した。割付因子を層別因子、投与群を単一の共変量とする層別Cox比例ハザードモデルにより、ハザード比とその両側95%信頼区間※7を推定した。
・PD-L1≧1%の症例および無作為化された全症例における奏効率(ORR:CR+PR、RECIST ver.1.1版による)※6
主要評価項目であるPD-L1≧1%の症例および無作為化された全症例のPFS※6において有意差がみられた場合にのみ検定を行った(階層的検定)。Clopper-Pearson法を用いて95%信頼区間を算出し、Cochran-Mantel-Haenszel法により割付因子で調整し、ORR(RECIST ver.1.1による)の差の推定値とその95%信頼区間※7、群間の層別オッズ比(Mantel-Haenszel推定量)とその95%信頼区間を算出した。
※7:正式に検定される場合は、100×(1–α)%信頼区間も同様に算出
【探索的評価項目】
・PD-L1≧1%の症例および無作為化された全症例における奏効期間(DOR)※6
最良総合効果が部分奏効(PR)または完全奏効(CR)であった症例(RECIST ver.1.1による)について、Kaplan-Meier法を用いて奏効期間の中央値とその95%信頼区間を推定した。
【その他の評価項目】
・最良総合効果(BOR)※6
投与群ごとにCR、PR、安定(SD)、進行(PD)、Unable to determine(UTD)の割合(RECIST ver.1.1による)を算出した。
【サブグループ解析】
年齢、性別、人種(日本人部分集団を含む)、ECOG PS、病期、組織学的Grade分類、組織学的分類、病変部位、転移臓器数、病態、喫煙歴、飲酒歴、初回診断から無作為化までの期間、前治療を因子として、OSおよびPFSの部分集団解析を実施した。また、投与群を共変量とした非層別Cox比例ハザードモデルを用いて、オプジーボ+ヤーボイ群およびオプジーボ+化学療法群の化学療法群に対するハザード比および95%信頼区間を算出し、forest plotを作成した。ORR、DOR、BORについて、日本人部分集団における解析を実施した。
OSおよびPFS(BICR)のPD-L1発現状況別(PD-L1[TPS]<1%)のサブグループ解析は、事前に計画した解析ではないものの、医薬品医療機器総合機構の求めに応じて解析した。OSおよびPFSの中央値とその95%信頼区間は主要評価項目と同様の方法で算出し、投与群間のハザード比とその95%信頼区間は非層別Cox比例ハザードモデルを用いて推定した。
投与方法
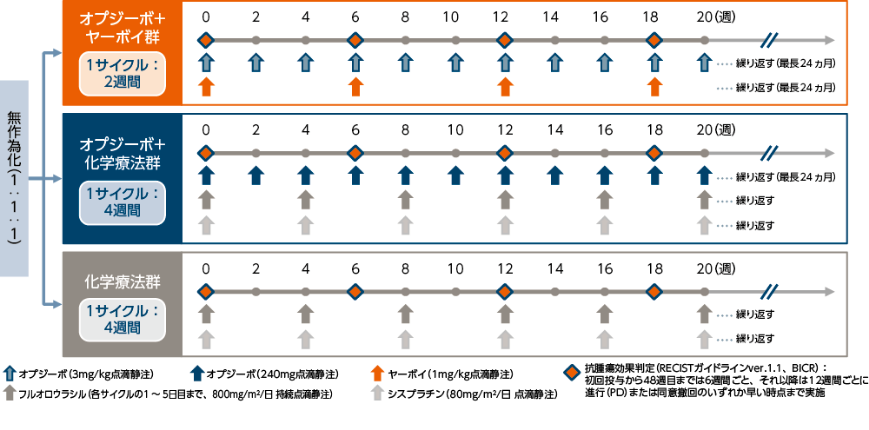
割付因子:PD-L1発現状況(≧1%/ <1%[判定不能を含む])、地域(東アジア[日本、韓国、台湾]/ アジアのその他の地域[中国、香港、シンガポール]/ 世界のその他の地域)、ECOG PS(0 / 1)、転移臓器数(1臓器以下/ 2臓器以上)
主な選択基準、除外基準
主な選択基準
- ・年齢18歳以上
- ・病理組織学的検査で食道の扁平上皮癌又は腺扁平上皮癌(主に扁平上皮癌が分化)であることが確認されている患者
- ・切除不能な進行、再発又は転移性の食道扁平上皮癌の患者
- ・根治的化学放射線療法や手術などの根治的な治療の対象とならない患者
- ・進行性又は転移性癌の一次治療として全身性の抗癌剤による治療歴がない患者
- ・CT又はMRIによって測定可能な病変(RECISTガイドライン1.1版)が少なくとも1つある患者
- ・ECOG PSが1以下の患者
主な除外基準
- ・食道病変の近位器官(大動脈又は気管)への明らかな腫瘍浸潤のため、出血又は瘻孔のリスクが高い患者
- ・無作為割付の少なくとも14日前に大手術又は重大な外傷の影響が消失していない患者
- ・過去3年以内に積極的な治療が必要な悪性腫瘍の既往がある患者
- ・活動性もしくは既知の自己免疫疾患、又はその疑いのある患者
- ・治験薬投与開始前14日以内に、副腎皮質ステロイド(プレドニゾン※換算量として1日量>10mg)又はその他の免疫抑制剤のいずれかによる全身治療を要する状態の患者
- ・抗PD-1抗体、抗PD-L1抗体、抗PD-L2抗体※、抗CD137抗体※、抗CTLA-4抗体、もしくはT細胞共刺激又はチェックポイント経路を特異的に標的とする他の抗体もしくは薬剤の投与を受けたことがある患者
※:本邦未承認
患者背景(全症例)1)
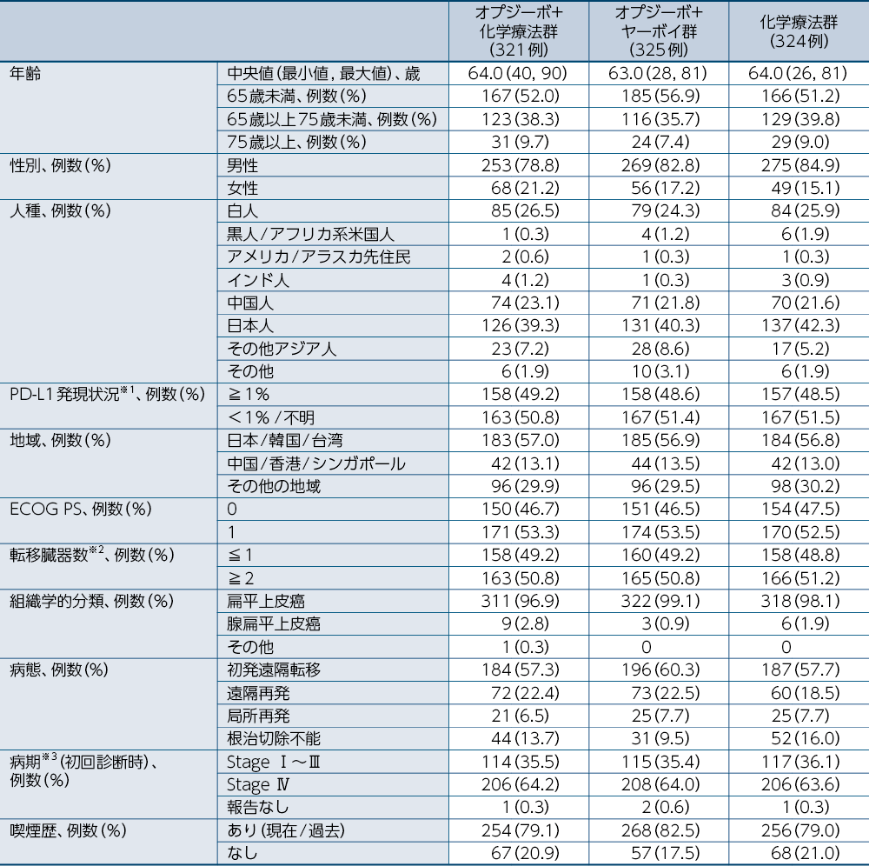
※1:症例報告書(CRF)に基づく ※2:BICR ※3:AJCC 第7版による分類
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
有効性
PD-L1≧1%の症例における全生存期間(OS)[主要評価項目]
●OSのKaplan-Meier曲線(オプジーボ+化学療法群、化学療法群)
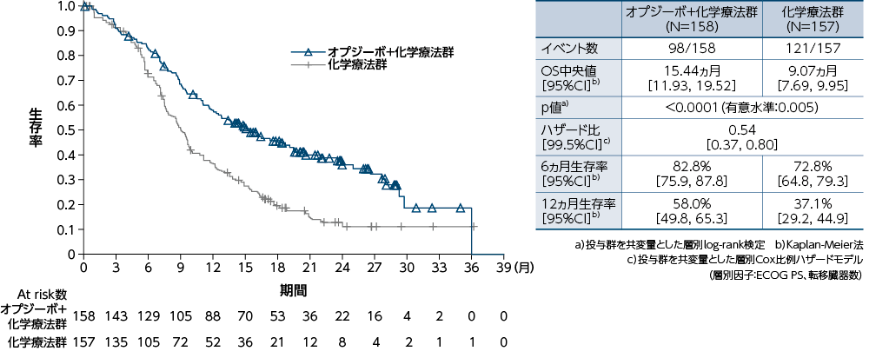
PD-L1≧1%の症例におけるOSについて、オプジーボ+化学療法群の化学療法群に対する優越性が統計学的に検証されました(p<0.0001a)、有意水準0.005)1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
無作為化された全症例における全生存期間(OS) [副次的評価項目]
●OSのKaplan-Meier曲線(オプジーボ+化学療法群、化学療法群)
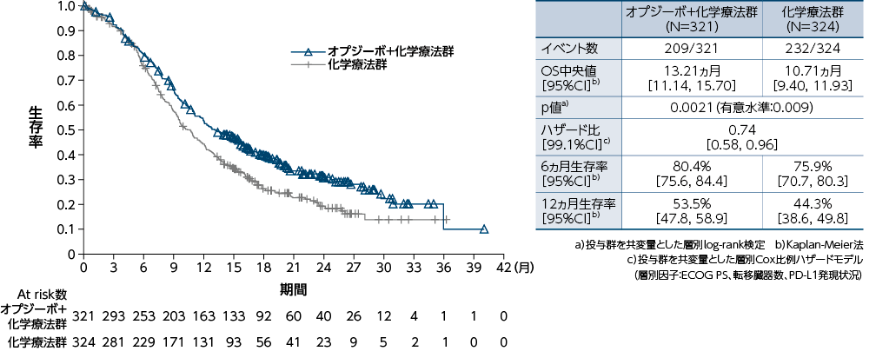
無作為化された全症例におけるOSについて、オプジーボ+化学療法群は化学療法群と比較して、統計学的に有意な延長が認められました(p=0.0021a)、有意水準0.009)1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
PD-L1≧1%の症例における全生存期間(OS)[主要評価項目]
●OSのKaplan-Meier曲線(オプジーボ+ヤーボイ群、化学療法群)
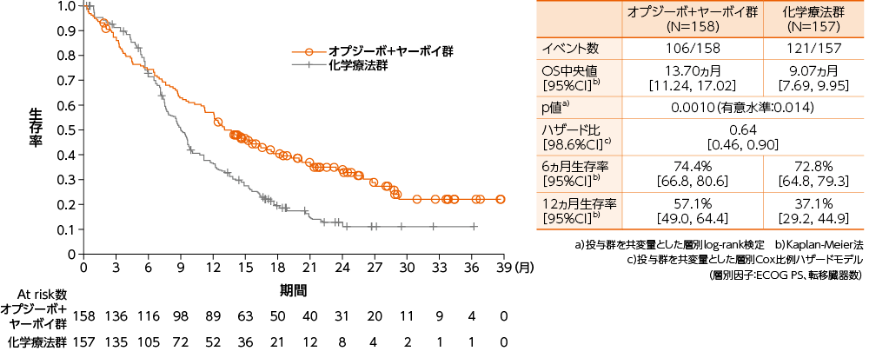
PD-L1≧1%の症例におけるOSについて、オプジーボ+ヤーボイ群の化学療法群に対する優越性が統計学的に検証されました(p=0.0010a)、有意水準0.014)1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
無作為化された全症例における全生存期間(OS) [副次的評価項目]
●OSのKaplan-Meier曲線(オプジーボ+ヤーボイ群、化学療法群)
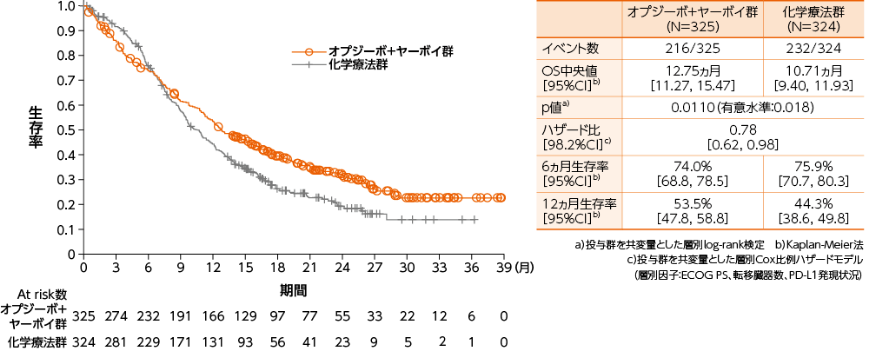
無作為化された全症例におけるOSについて、オプジーボ+ヤーボイ群は化学療法群と比較して、統計学的に有意な延長が認められました(p=0.0110a)、有意水準0.018)1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
PD-L1≧1%の症例における無増悪生存期間(PFS)(BICR)[主要評価項目]
●PFSのKaplan-Meier曲線(オプジーボ+化学療法群、化学療法群)
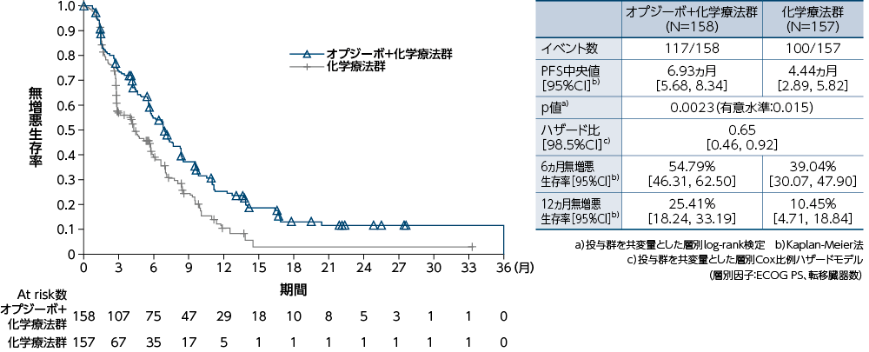
PD-L1≧1%の症例におけるPFSについて、オプジーボ+化学療法群の化学療法群に対する優越性が統計学的に検証されました(p=0.0023a)、有意水準0.015)1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
無作為化された全症例における無増悪生存期間(PFS) (BICR) [副次的評価項目]
●PFSのKaplan-Meier曲線(オプジーボ+化学療法群、化学療法群)
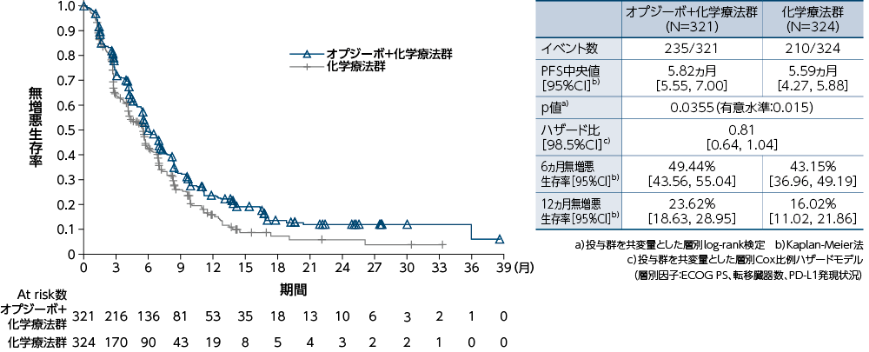
無作為化された全症例におけるPFSについて、オプジーボ+化学療法群は化学療法群と比較して、統計学的に有意な延長は認められませんでした(p=0.0355a)、有意水準0.015)1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
PD-L1≧1%の症例における無増悪生存期間(PFS)(BICR)[主要評価項目]
●PFSのKaplan-Meier曲線(オプジーボ+ヤーボイ群、化学療法群)
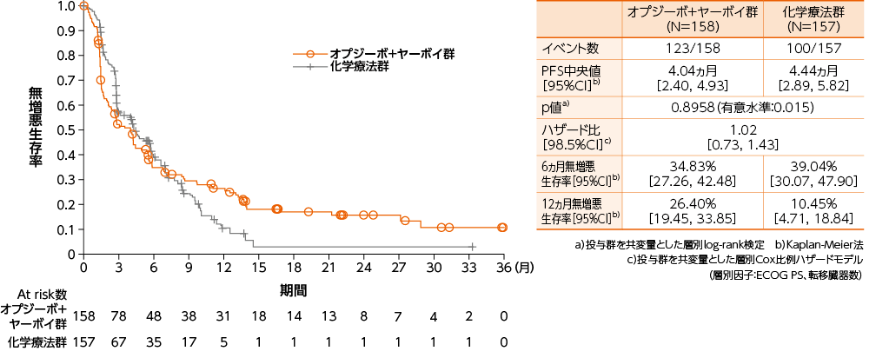
PD-L1≧1%の症例におけるPFSについて、オプジーボ+ヤーボイ群の化学療法群に対する優越性は統計学的に検証されませんでした(p=0.8958a)、有意水準0.015)1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
無作為化された全症例における無増悪生存期間(PFS) (BICR) [副次的評価項目]
●PFSのKaplan-Meier曲線(オプジーボ+ヤーボイ群、化学療法群)
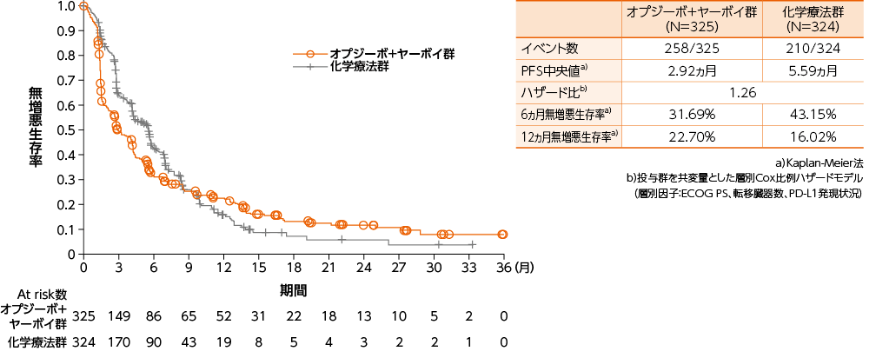
無作為化された全症例におけるPFS中央値は、オプジーボ+ヤーボイ群で2.92ヵ月、化学療法群で5.59ヵ月でした1)※1。
※1:PD-LI≧1%の症例で優越性が検証されなかったため、検定手順上無作為化された全症例におけるPFS(BICR)の正式な検定は行われなかった。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
安全性
安全性(全症例)
●いずれかの群で5%以上に発現した副作用一覧
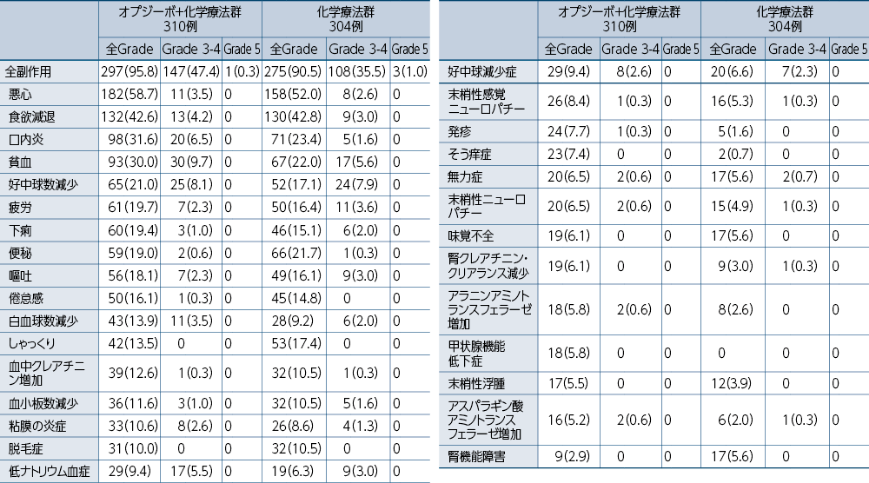
例数(%) MedDRA ver 23.1J CTCAE ver 4.0
副作用の発現頻度は、治験薬最終投与後30日以内に発現・増悪した事象を対象に集計しました。
因果関係は、「関連あり」「関連なし」の2段階で判定され、「関連あり」と判定された場合に副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。
留意すべき副作用
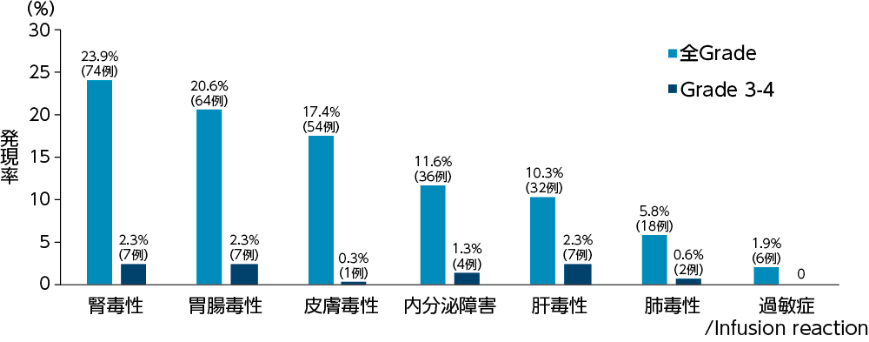
安全性(全症例)
●いずれかの群で5%以上に発現した副作用一覧
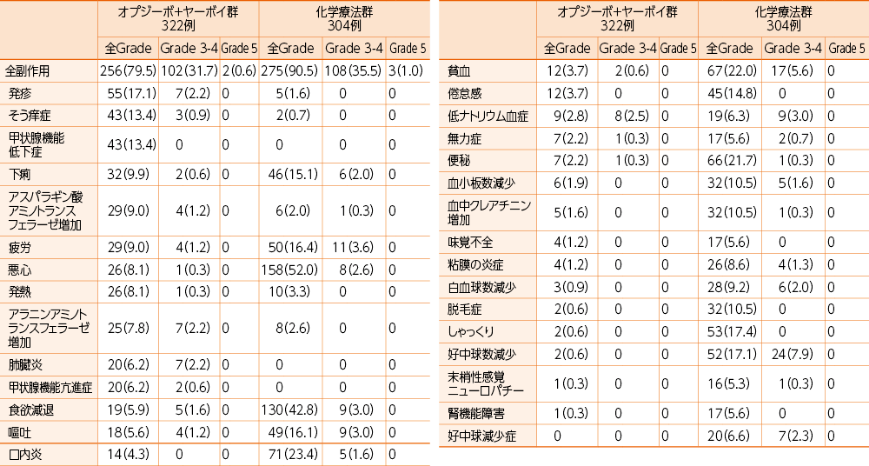
例数(%) MedDRA ver 23.1J CTCAE ver 4.0
副作用の発現頻度は、治験薬最終投与後30日以内に発現・増悪した事象を対象に集計しました。
因果関係は、「関連あり」「関連なし」の2段階で判定され、「関連あり」と判定された場合に副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。
留意すべき副作用
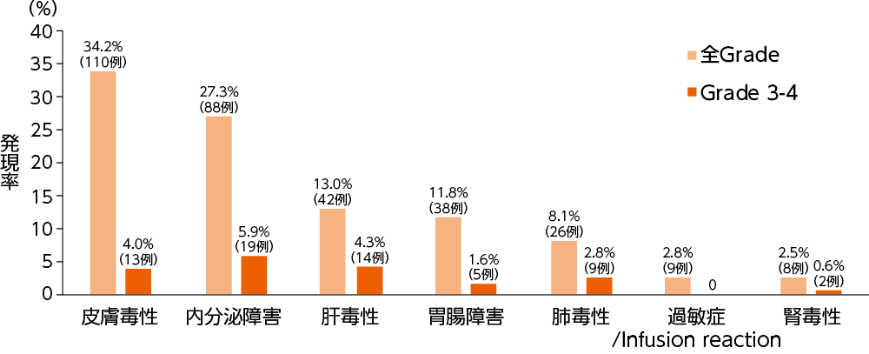
安全性(全症例)1,2)
副作用は、オプジーボ+化学療法群で95.8%(297/310例)、オプジーボ+ヤーボイ群で79.5%(256/322例)、化学療法群で90.5%(275/304例)に認められました1)。
・オプジーボ+化学療法群1)
オプジーボ+化学療法群の310例において発現率が10%以上の副作用は、悪心58.7%(182例)、食欲減退42.6%(132例)、口内炎31.6%(98例)、貧血30.0%(93例)、好中球数減少21.0%(65例)、疲労19.7%(61例)、下痢19.4%(60例)、便秘19.0%(59例)、嘔吐18.1%(56例)、倦怠感16.1%(50例)、白血球数減少13.9%(43例)、しゃっくり13.5%(42例)、血中クレアチニン増加12.6%(39例)、血小板数減少11.6%(36例)、粘膜の炎症10.6%(33例)、脱毛症10.0%(31例)でした。
重篤な副作用は23.9%(74例)に認められました。発現率が1%以上の重篤な副作用は、急性腎障害1.9%(6例)、大腸炎1.6%(5例)、口内炎1.6%(5例)、肺炎1.6%(5例)、肺臓炎1.3%(4例)、嘔吐1.3%(4例)、低ナトリウム血症1.3%(4例)、食欲減退1.3%(4例)、発熱性好中球減少症1.3%(4例)、下痢1.0%(3例)、悪心1.0%(3例)、疲労1.0%(3例)、貧血1.0%(3例)でした。
投与中止に至った副作用は34.2%(106例)に認められました。発現率が2%以上の投与中止に至った副作用は、血中クレアチニン増加3.5%(11例)、末梢性感覚ニューロパチー2.6%(8例)、肺臓炎2.6%(8例)、慢性腎臓病2.6%(8例)、腎クレアチニン・クリアランス減少2.3%(7例)でした。
オプジーボ+化学療法群で死亡に至った副作用は、腸壁気腫症1例、肺炎1例、肺臓炎/気道感染1例、急性腎障害1例、肺臓炎1例でした。
・オプジーボ+ヤーボイ群
オプジーボ+ヤーボイ群の322例において発現率が10%以上の副作用は、発疹17.1%(55例)、甲状腺機能低下症13.4%(43例)、そう痒症13.4%(43例)でした1)。
重篤な副作用は32.0%(103例)に認められました。発現率が2%以上の重篤な副作用は、肺臓炎3.7%(12例)、肝機能異常2.5%(8例)、副腎機能不全2.2%(7例)でした1)。
投与中止に至った副作用は17.7%(57例)に認められました。発現率が2%以上の投与中止に至った副作用は、肺臓炎2.5%(8例)でした1)。
オプジーボ+ヤーボイ群で死亡に至った副作用は、肺臓炎2例、急性呼吸窮迫症候群1例、肺塞栓症1例、間質性肺疾患1例、急性腎障害1例、全身健康状態悪化1例、内出血1例でした2)。
・化学療法群1)
化学療法群の304例において、重篤な副作用は16.1%(49例)に認められました。発現率が2%以上の重篤な副作用は、嘔吐3.0%(9例)でした。
投与中止に至った副作用は19.4%(59例)に認められました。発現率が2%以上の投与中止に至った副作用は、血中クレアチニン増加3.6%(11例)、腎機能障害2.3%(7例)でした。
化学療法群で死亡に至った副作用は、急性呼吸不全1例、敗血症性ショック1例、敗血症1例、急性腎障害1例、死亡1例、肺炎1例でした。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
2) Doki Y. et al.: N. Engl. J. Med., 386: 449, 2022.
[利益相反]本試験は、Bristol-Myers Squibbおよび小野薬品工業の支援をうけて実施された。
その他
PD-L1≧1%の症例における奏効期間(DOR)(BICR)[探索的評価項目]・[サブグループ解析]、無作為化された全症例におけるDOR(BICR)[探索的評価項目]
●DOR(BICR)のKaplan-Meier曲線(オプジーボ+化学療法群、化学療法群)
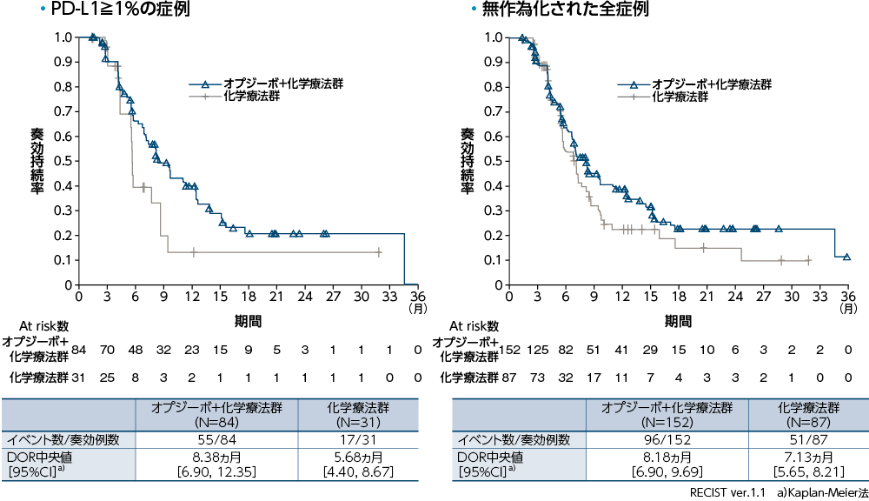
PD-L1≧1%の症例におけるDOR中央値は、オプジーボ+化学療法群で8.38ヵ月、化学療法群で5.68ヵ月でした。無作為化された全症例においては、オプジーボ+化学療法群で8.18ヵ月、化学療法群で7.13ヵ月でした1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
PD-L1≧1%の症例における奏効率(ORR)(BICR)[副次的評価項目]・[サブグループ解析]、無作為化された全症例におけるORR(BICR)[副次的評価項目]
PD-L1≧1%の症例における最良総合効果(BOR)(BICR)[その他の評価項目]・[サブグループ解析]、無作為化された全症例におけるBOR(BICR)[その他の評価項目]
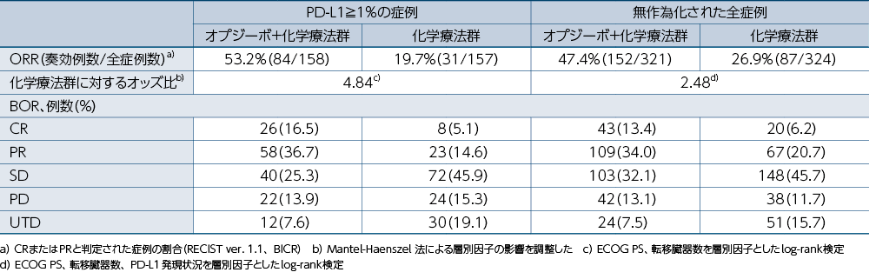
PD-L1≧1%の症例におけるORR(RECIST 1.1版によるBICR)は、オプジーボ+化学療法群で53.2%、化学療法群で19.7%でした。無作為化された全症例においては、オプジーボ+化学療法群で47.4%、化学療法群で26.9%でした1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
PD-L1≧1%の症例における奏効期間(DOR)(BICR)[探索的評価項目]・[サブグループ解析]、無作為化された全症例におけるDOR(BICR)[探索的評価項目]
●DOR(BICR)のKaplan-Meier曲線(オプジーボ+ヤーボイ群、化学療法群)
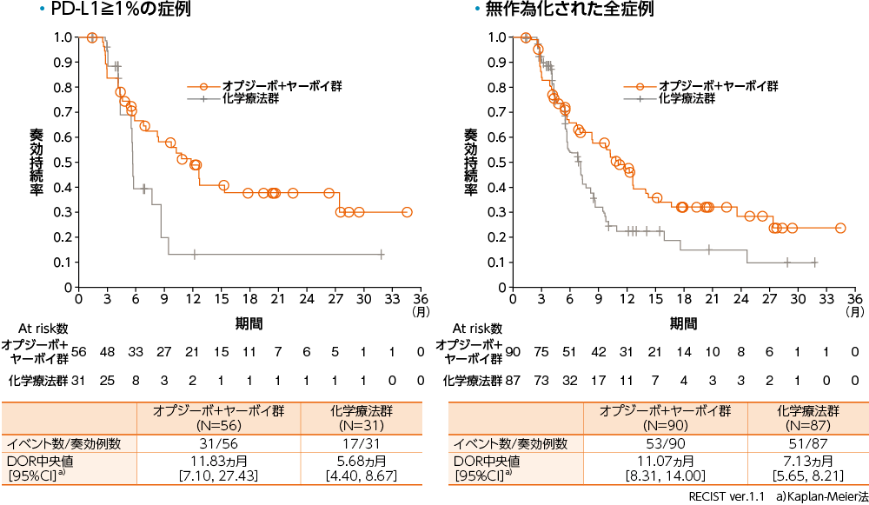
PD-L1≧1%の症例におけるDOR中央値は、オプジーボ+ヤーボイ群で11.83ヵ月、化学療法群で5.68ヵ月でした。無作為化された全症例においては、オプジーボ+ヤーボイ群で11.07ヵ月、化学療法群で7.13ヵ月でした1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
PD-L1≧1%の症例における奏効率(ORR)(BICR)[副次的評価項目]・[サブグループ解析]、無作為化された全症例におけるORR(BICR)[副次的評価項目]
PD-L1≧1%の症例における最良総合効果(BOR)(BICR)[その他の評価項目]・[サブグループ解析]、無作為化された全症例におけるBOR(BICR)[その他の評価項目]
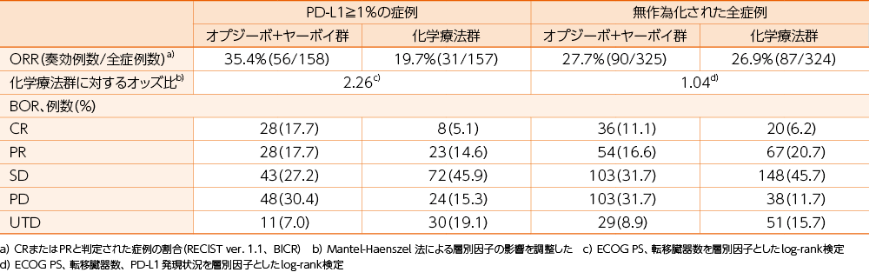
PD-L1≧1%の症例におけるORR(RECIST 1.1版によるBICR)は、オプジーボ+ヤーボイ群で35.4%、化学療法群で19.7%でした。無作為化された全症例において、オプジーボ+ヤーボイ群で27.7%、化学療法群で26.9%でした1)。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
CheckMate 648試験(全症例) 有効性まとめ1)
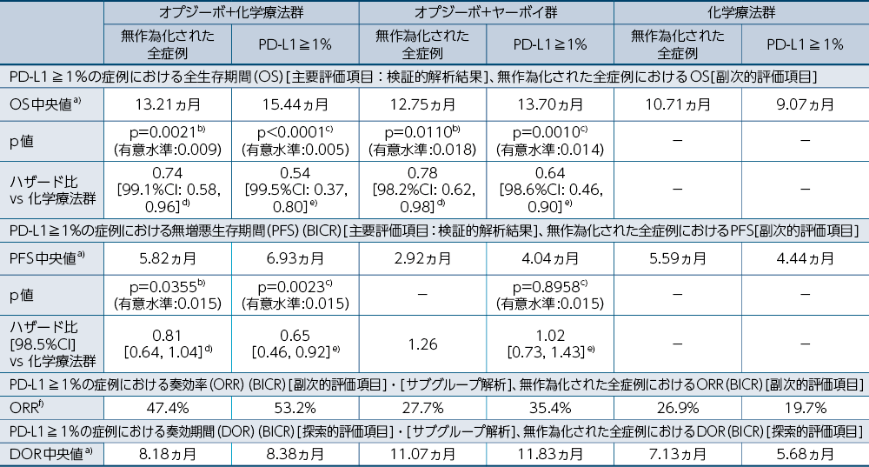
本試験は、オプジーボ+化学療法群と化学療法群、またはオプジーボ+ヤーボイ群と化学療法群との比較を行うことを目的として実施された。
a)Kaplan-Meier法 b)投与群を共変量とし、ECOG PS、転移臓器数、PD-L1発現状況を層別因子としたlog-rank検定
c)投与群を共変量とし、ECOG PS、転移臓器数を層別因子としたlog-rank検定
d)投与群を共変量とし、ECOG PS、転移臓器数、PD-L1発現状況を層別因子としたCox比例ハザードモデル
e)投与群を共変量とし、ECOG PS、転移臓器数を層別因子としたCox比例ハザードモデル
f)CRまたはPRと判定された症例の割合(RECIST ver1.1)
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-50/BMS CA209648)試験成績(社内資料)承認時評価資料
PD-L1発現状況別のOS[事前規定のない探索的な解析・サブグループ解析]※1
全生存期間(OS)について、PD-L1発現率(TPS)別に探索的に解析を行った結果を以下に示します。
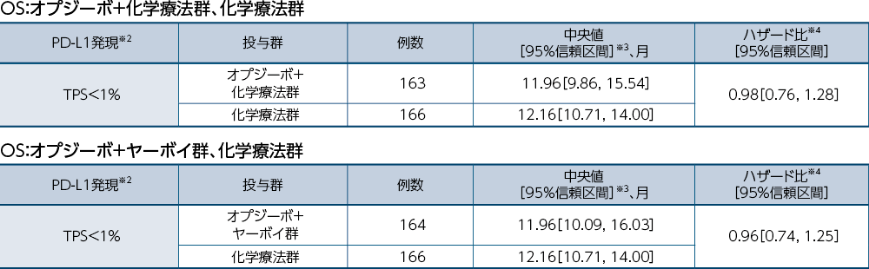
※1:本解析は事前に計画した解析ではないものの、医薬品医療機器総合機構の求めに応じて解析し、承認審査過程で評価を受けました
※2:PD-L1判定不能であった症例は除外
※3:Kaplan-Meier法
※4:投与群を共変量とした非層別Cox比例ハザードモデル
オプジーボ
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の食道癌
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の食道癌〉
5.17 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.25、17.1.26参照]
6. 用法及び用量(一部抜粋)
〈根治切除不能な進行・再発の食道癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔、1回360mgを3週間間隔又は1回480mgを4週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の食道癌〉
7.13 化学療法未治療患者に対する本剤単独投与の有効性及び安全性は確立していない。7.14 他の抗悪性腫瘍剤との併用投与の有効性は、PD-L1発現率(TPS)により異なる傾向が示唆されている。TPSについて、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤を含む併用療法の必要性について慎重に判断すること。[17.1.26参照]
7.15 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知した上で、選択すること。[17.1.26参照]
ヤーボイ
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の食道癌
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の食道癌〉
5.13 本剤の手術の補助療法における有効性及び安全性は確立していない。
5.14「 17.臨床成績」の項の内容を熟知し,本剤の有効性及び安全性を十分に理解した上で,適応患者の選択を行うこと。[17.1.10 参照]
6. 用法及び用量(一部抜粋)
〈 根治切除不能な進行・再発の食道癌〉
ニボルマブ(遺伝子組換え)との併用において,通常,成人にはイピリムマブ(遺伝子組換え)として1回1mg/kg(体重)を6週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.2 本剤は,30分かけて点滴静注すること。
〈根治切除不能な進行・再発の食道癌〉
7.5 ニボルマブ(遺伝子組換え)との併用投与の有効性は,PD-L1発現率(TPS)により異なる傾向が示唆されている。TPSについて,「17.臨床成績」の項の内容を熟知し,本剤の有効性及び安全性を十分に理解した上で,ニボルマブ(遺伝子組換え)との併用療法の必要性について慎重に判断すること。[17.1.10参照]

















