ATTRACTION-2(国際共同第Ⅲ相試験)概要
本試験は進行・再発胃癌に対する免疫チェックポイント阻害薬の有用性を検討した最初の第Ⅲ相試験です。
試験概要
試験デザイン
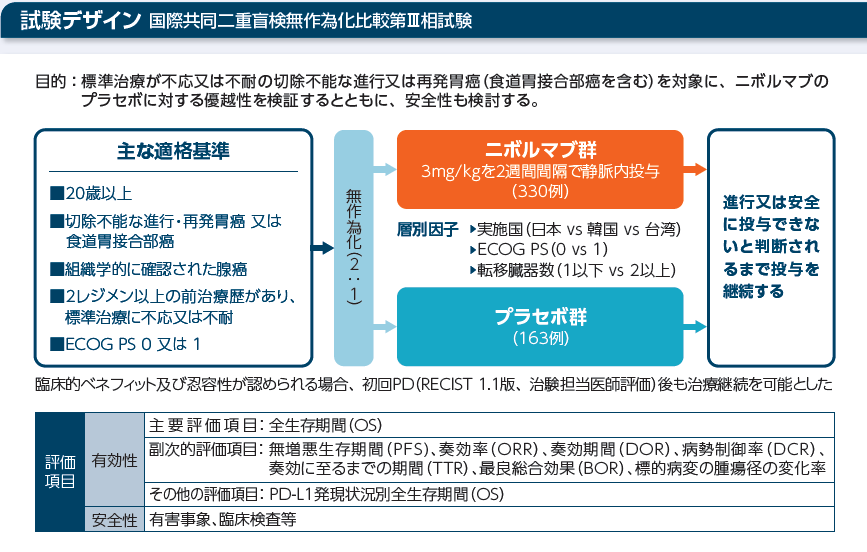
解析計画
【主要評価項目】
全生存期間(OS)は、必要イベント数261件の約75%のイベント(196件)が発生した時点で、事前の計画に従って中間解析を実施し、再算定後の必要イベント328件が発生した時点で最終解析を実施した。割付因子を層別因子(実施国、ECOG PS、転移臓器数)とした層別log-rank検定(片側有意水準2.5%)により投与群間の比較を行った。さらに、主たる解析の感度分析として、log-rank検定による投与群間の比較を行った。割付因子を層別因子とした層別Cox比例ハザードモデルを用いて、ニボルマブ群のプラセボ群に対するハザード比及びその両側95%信頼区間を算出した。Kaplan-Meier法を用いて中央値及びその両側95%信頼区間と、3、6、9、12、18、24及び36ヵ月時点の生存率及びその両側95%信頼区間を投与群ごとに算出した。
【副次的評価項目】
無増悪生存期間(PFS)は、割付因子を層別因子とした層別log-rank検定により投与群間の比較を行った。割付因子を層別因子とした層別Cox比例ハザードモデルを用いて、ニボルマブ群のプラセボ群に対するハザード比及びその両側95%信頼区間を算出した。Kaplan-Meier法を用いて中央値及びその両側95%信頼区間と、3、6、9、12、18、24及び36ヵ月時点のPFS率及びその両側95%信頼区間を投与群ごとに算出した。奏効率(ORR)及び病勢制御率(DCR)に対して、割合及びその両側95%信頼区間(Clopper-Pearson法)を投与群ごとに算出した。割付因子を層別因子としたCochran-Mantel-Haensze(l CMH)検定により投与群間の比較を行った。割付因子を層別因子としたCMH法を用いて、ニボルマブ群のプラセボ群に対するオッズ比及びその両側95%信頼区間、並びにリスク差及びその両側95%信頼区間を算出した。最良総合効果(BOR) [完全奏効(CR)、部分奏効(PR)、安定(SD)、進行(PD)、評価不能(NE)]の割合及びその両側95%信頼区間(Clopper-Pearson法)を投与群ごとに算出した。奏効期間(DOR)について、Kaplan-Meier曲線を投与群ごとに表示した。またBORがCR又はPRの症例を対象に、Kaplan-Meier法を用いて中央値及びその両側95%信頼区間を投与群ごとに算出した。奏効に至るまでの期間(TTR)は、Kaplan-Meier曲線を投与群ごとに表示し、要約統計量を投与群ごとに算出した。標的病変の腫瘍径和の最大変化率に対して、waterfall plotを作成した。
【サブグループ解析】
解析計画の有効性で設定された評価項目において規定された日本人部分集団を対象としたサブグループ解析を行った。OSについてベースライン時のPD-L1発現状況別(1%以上と1%未満)にサブグループ解析を行うことが事前に規定されていた。また、事前に規定された実施国、年齢、性別、PS、再発の有無、病変の部位、組織型、肉眼型、転移臓器の数、腹膜転移の有無、肝転移の有無、標的病変の有無、前治療(手術・放射線療法)の有無及び前治療レジメン数を層別因子とし、OSのサブグループ解析を行った。
1)小野薬品工業 : 国際共同第Ⅲ相(ONO-4538-12)試験成績(社内資料) 承認時評価資料
2) Kang YK. et al. Lancet. 390: 2461-2471, 2017.
[利益相反]本試験は、Bristol-Myers Squibbの資金提供、及び小野薬品工業からの支援をうけて実施された。
患者背景
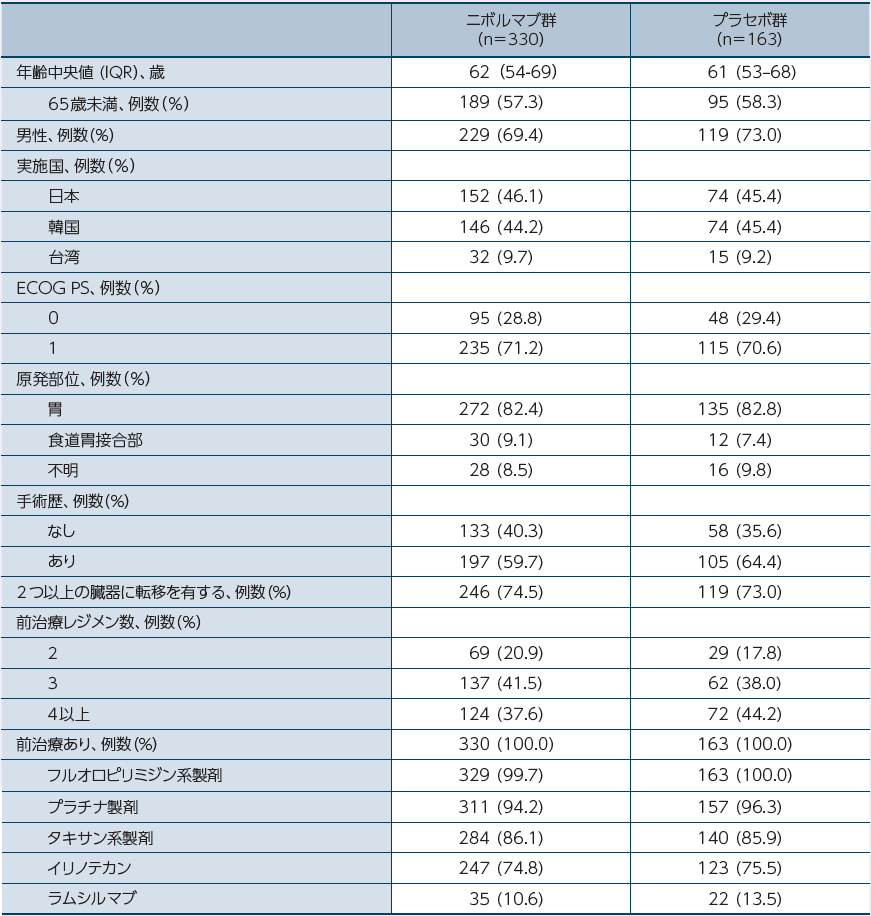
IQR:4分位範囲
1)小野薬品工業 : 国際共同第Ⅲ相(ONO-4538-12)試験成績(社内資料) 承認時評価資料
有効性
全生存期間(OS)[主要評価項目]
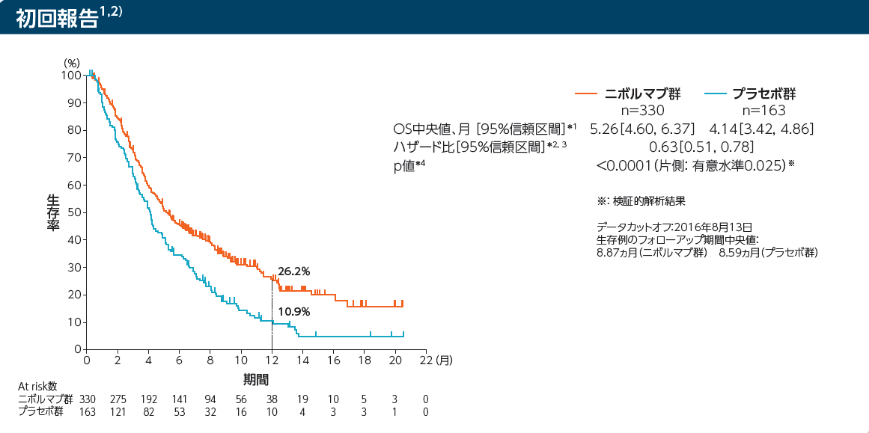
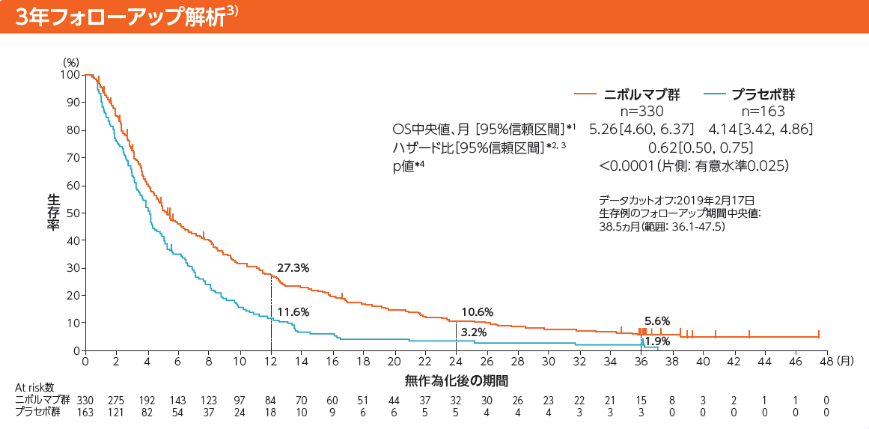
Kaplan-Meier曲線上のマークは打ち切り例を示す
*1:Kaplan-Meier法 *2:層別Cox比例ハザードモデル
*3:IWRSのデータに基づく割付因子(実施国、ECOG PS、転移臓器数)を層別因子とした。 *4:層別log-rank検定
1年生存率はニボルマブ群27.3%、プラセボ群11.6%でした
2年生存率はニボルマブ群10.6%、プラセボ群3.2%でした
3年生存率はニボルマブ群5.6%、プラセボ群1.9%でした
無増悪生存期間(PFS)[副次的評価項目]
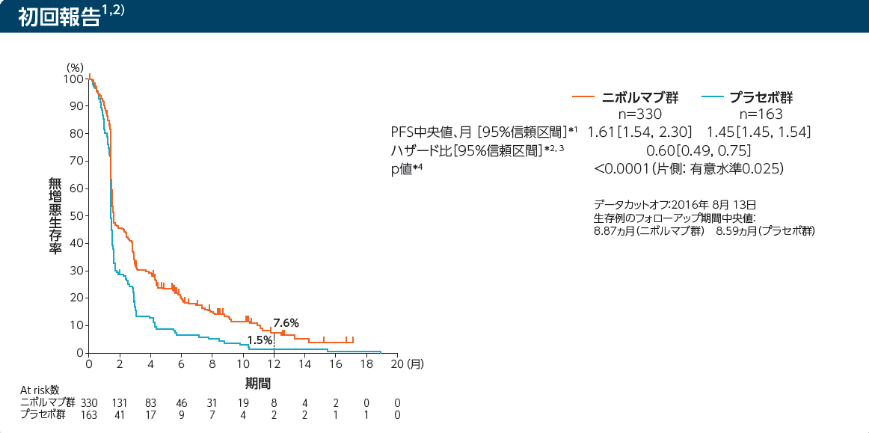
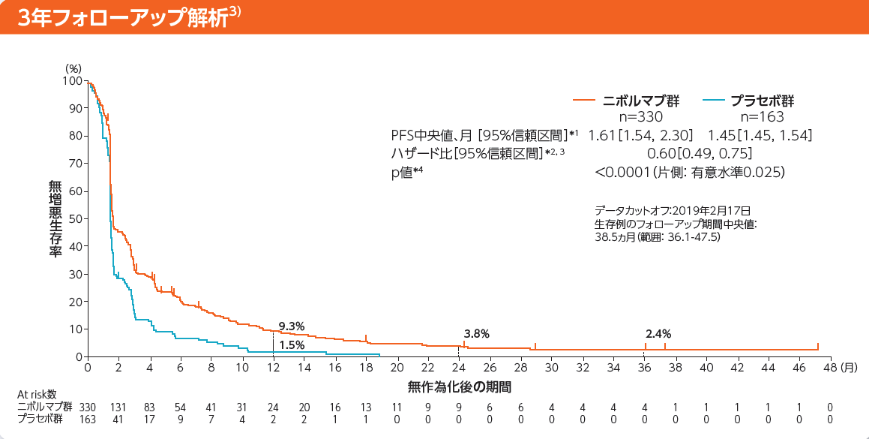
Kaplan-Meier曲線上のマークは打ち切り例を示す
*1:Kaplan-Meier法 *2:層別Cox比例ハザードモデル
*3:IWRSのデータに基づく割付因子(実施国、ECOG PS、転移臓器数)を層別因子とした。 *4:層別log-rank検定
1)小野薬品工業 : 国際共同第Ⅲ相(ONO-4538-12)試験成績(社内資料) 承認時評価資料
2)Kang YK. et al. Lancet. 390 : 2461-2471, 2017.
[利益相反]本試験は、Bristol-Myers Squibbの資金提供、及び小野薬品工業からの支援をうけて実施された。
3)Boku N, et al. Gastric Cancer. 2021; https://doi.org/10.1007/s10120-021-01173-w
[利益相反]本試験は、Bristol-Myers Squibbの資金提供、及び小野薬品工業からの支援をうけて実施された。
1年PFS率はニボルマブ群9.3%、プラセボ群1.5%でした
2年PFS率はニボルマブ群3.8%でした
3年PFS率はニボルマブ群2.4%でした
奏効率(ORR)、病勢制御率(DCR)[副次的評価項目]
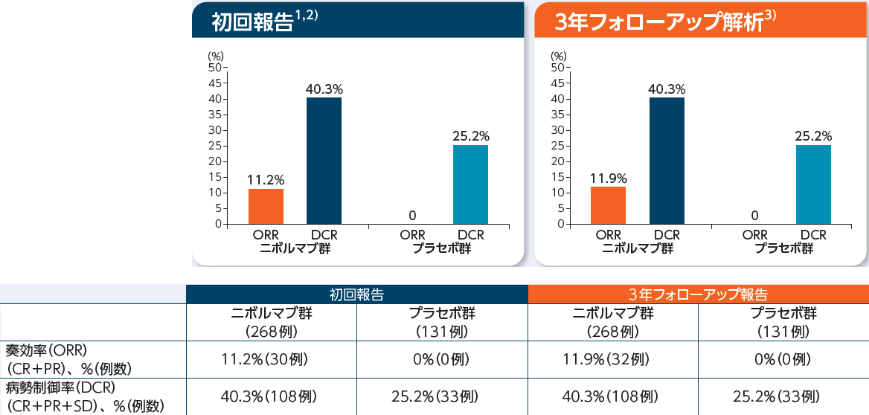
ニボルマブ群における3年フォローアップ時のORRは11.9%(32/268例)、DCRは40.3%(108/268例)でした 3年フォローアップ時のBORはCR 3例、PR 29例、SD 76例、PD 124例でした
最良総合効果(BOR)[副次的評価項目]
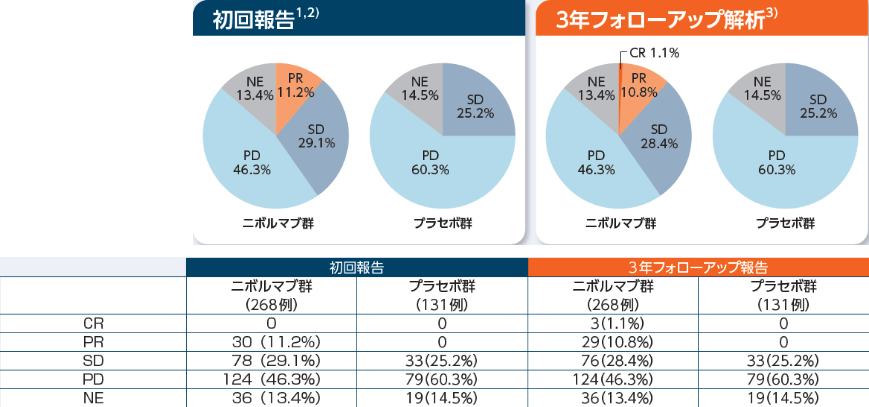
初回報告
データカットオフ:2016年8月13日
生存例のフォローアップ期間中央値:8.87ヵ月(ニボルマブ群) 8.59ヵ月(プラセボ群)
3年フォローアップ
データカットオフ:2019年2月17日
生存例のフォローアップ期間中央値:38.5ヵ月(範囲: 36.1-47.5)
奏効期間(DOR)[副次的評価項目]

*: Kaplan-Meier法
ニボルマブ群における3年フォローアップ時のDORは10.12ヵ月でした
安全性
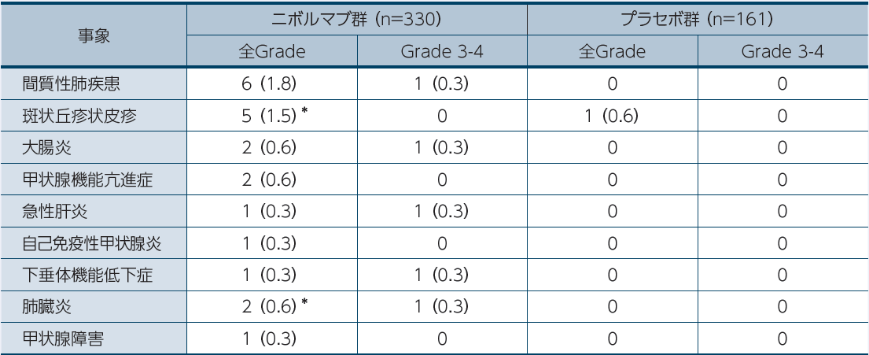
留意すべき副作用
3年フォローアップ時において、ニボルマブ群で間質性肺疾患が6例(1.8%)などの留意すべき副作用が確認されました。また、初回報告では斑状丘疹状皮疹4例、肺臓炎1例が報告されましたが、それに加えてフォローアップ期間中に各1例の発現が認められました。副作用の発現には長期間にわたり注意が必要です。
例数(%)
*:初回報告2)では斑状丘疹状皮疹4例、肺臓炎1例が報告されましたが、それに加えてフォローアップ期間中に各1例の発現が認められました。
留意すべき副作用は、免疫介在性の可能性があり、頻回なモニタリングと介入を必要とする副作用です。
データカットオフ:2019年2月17日
生存例のフォローアップ期間中央値: 38.5ヵ月(範囲: 36.1-47.5)
1)小野薬品工業 : 国際共同第Ⅲ相(ONO-4538-12)試験成績(社内資料) 承認時評価資料
2)Kang YK. et al. Lancet. 390 : 2461-2471, 2017.
[利益相反]本試験は、Bristol-Myers Squibbの資金提供、及び小野薬品工業からの支援をうけて実施された。
3)Boku N, et al. Gastric Cancer. 2021; https://doi.org/10.1007/s10120-021-01173-w
[利益相反]本試験は、Bristol-Myers Squibbの資金提供、及び小野薬品工業からの支援をうけて実施された。
その他
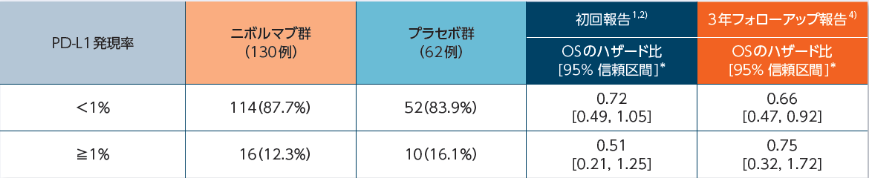
PD-L1発現率別OSのハザード比[主要評価項目・サブグループ解析]
3年フォローアップにおけるPD-L1発現率別OSのハザード比は、1%未満では0.66、1%以上では0.75でした4)
*: 非層別Cox比例ハザードモデル
1)小野薬品工業 : 国際共同第Ⅲ相(ONO-4538-12)試験成績(社内資料) 承認時評価資料
2)Kang YK. et al. Lancet. 390 : 2461-2471, 2017.
[利益相反]本試験は、Bristol-Myers Squibbの資金提供、及び小野薬品工業からの支援をうけて実施された。
3)Boku N, et al. Gastric Cancer. 2021; https://doi.org/10.1007/s10120-021-01173-w
4)Boku N, et al. Gastric Cancer. 2021; https://doi.org/10.1007/s10120-021-01173-w. Supplementary material
[利益相反]本試験は、Bristol-Myers Squibbの資金提供、及び小野薬品工業からの支援をうけて実施された。
4. 効能又は効果(一部抜粋)
がん化学療法後に増悪した治癒切除不能な進行・再発の胃癌
6. 用法及び用量(一部抜粋)
〈がん化学療法後に増悪した治癒切除不能な進行・再発の胃癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。

















