ATTRACTION-4(国際共同第Ⅲ相試験)概要
日本・韓国・台湾で実施された、HER2陰性の切除不能な進行又は再発胃癌の一次治療においてオプジーボ+化学療法群のプラセボ+化学療法群に対する有効性の検証と安全性の検討を目的とした二重盲検無作為化比較試験
試験概要
試験デザイン
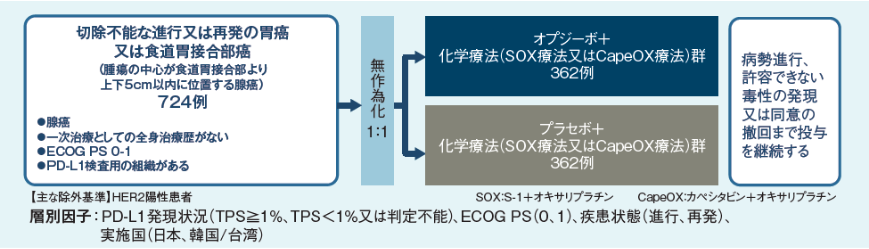
【目的】
HER2 陰性の化学療法未治療の切除不能な進行又は再発胃癌(食道胃接合部癌を含む)を対象に、オプジーボと化学療法(フッ化ピリミジン系抗悪性腫瘍剤及びプラチナ製剤)の併用療法群のプラセボ+化学療法群に対する優越性を検証するとともに、安全性も検討する。
【試験デザイン】
国際共同プラセボ対照二重盲検無作為化比較第Ⅲ相試験[優越性試験]
【対象】
HER2 陰性の化学療法未治療の切除不能な進行又は再発胃癌(食道胃接合部癌を含む)患者724 例(日本人395例)
[オプジーボ+化学療法群:362 例(日本人198 例)、プラセボ+化学療法群:362例(日本人197例)]
【投与方法】
オプジーボ+化学療法群:
オプジーボ360mgとSOX 療法※1 又はCapeOX 療法※2を3 週間間隔(6週間を1サイクル)で投与した。
プラセボ+化学療法群:
プラセボとSOX 療法又はCapeOX 療法を3週間間隔(6 週間を1サイクル)で投与した。
※1: SOX 療法
オキサリプラチン130mg/m2を3週間間隔で点滴静注、テガフール・ギメラシル・オテラシルカリウム配合剤(S-1)※340mg/m2 を1日2回、14日間経口投与後、7日間休薬した。
※2: CapeOX 療法
オキサリプラチン130mg/m2を3 週間間隔で点滴静注、カペシタビン※41000mg/m2 を1日2回 、14日間経口投与後、7日間休薬した。
※3 : 本邦におけるS-1の用法及び用量(一部抜粋)は「、通常、成人には初回投与量(1回量)を体表面積に合せて次の基準量(1.25m2未満;40mg/回、1 .25m2以上~1.5m2未満;50mg/回、1.5m2 以上;60mg/回)とし、朝食後及び夕食後の1日2 回、28日間連日経口投与し、その後14 日間休薬する。これを1クールとして投与を繰り返す。なお、患者の状態により適宜増減する。」である。
※4: 本邦におけるカペシタビンの用法及び用量(胃癌:白金製剤との併用)は、「体表面積にあわせて次の投与量(1.36m2 未満;1,200mg/ 回、1.36 m2 以上1.66m2未満;1,500mg/回、1.66 m2 以上1.96m2 未満;1,800mg/回、1.96m2 以上;2,100mg/回)を朝食後と夕食後30分以内に1日2回、14日間連日経口投与し、その後7日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。」である。
【評価項目】
有効性
主要評価項目:無増悪生存期間( PFS )[ RECIST ガイドライン1.1版に基づくIRRC※5 判定]、全生存期間(OS)
副次的評価項目:奏効率(ORR)[ RECIST ガイドライン1.1 版に基づくIRRC 判定及び試験実施施設の医師判定]、奏効期間(DOR)、病勢制御率(DCR)、奏効に至るまでの期間( TTR)、最良総合効果(BOR) 等
※5:独立画像判定委員会
安全性
有害事象、臨床検査 等
その他の評価項目: 各薬剤の投与状況、後治療(薬物療法、放射線及び手術療法を含む)への移行率
【解析計画】
主要評価項目: 有意水準(両側)は全体で0.05とし、Group sequentialHolm variable 法による調整で、PFS及びOS にそれぞれ0.04 及び
0.01を割り当てた(図)。PFS は、イベントが325 件( 必要イベント数の約75%)発生した時点で中間解析を実施し、優越性を検証した。PFS の中間解析及び最終解析の有意水準は、解析時点の実際のPFSイベント数に基づいて、O’Brien-Fleming 型のLan-DeMets 法によるα消費関数を用いて決定した(中間解析:両側有意水準0.0149)。OSは、中間解析を実施せず、PFS でオプジーボ+化学療法群の優越性が示され、イベントが475件発生した時点で最終解析を実施し、優越性を検証した。OSの有意水準は、PFS の中間解析で帰無仮説が棄却されたため、再分配され0.05で実施された(図)。主解析として、PFS 及びOSは、PD-L1発現状況(TPS)、ECOG PS、疾患状態、及び実施国を層別因子とした層別log-rank検定を用いて、2群間を比較した。投与群間のハザード比及びその両側100×(1-α)%信頼区間(PFS:98.51%、OS:95%)は、投与群を単一の共変量とし、上記因子を層別因子とした層別Cox 比例ハザードモデルを用いて推定した。副次的解析として、PFS 及びOSは、Kaplan-Meier 法を用いて中央値を推定し、その95%信頼区間は二重対数変換のBrookmeyer-Crowley法を用いて算出した。PFS 率(6、9、12、15、18、21、24ヵ月時点)並びにOS率(3、6、 9、12、15、18、21、24ヵ月時点)はKaplan-Meier 法を用いて推定し、各時点の95%信頼区間はGreenwood 法を用いて算出した。
副次的評価項目: ORR 及びDCRは、Clopper-Pearson法を用いて投与群ごとの割合及びその両側95%信頼区間を算出した。主要評価項目と同一の因子を層別因子としたCochran-Mantel-Haenszel 検定を用いて、2群間を比較した。また、同様の層別因子で調整した2群間のオッズ比及びその両側95%信頼区間、割合の差及びその両側95%信頼区間はCochran-Mantel-Haenszel 法を用いて算出した。BOR は、投与群ごとにCR、PR、SD、PD及びNEの割合を算出し、CR、PR 及びSDの割合の両側95%信頼区間はClopper-Pearson 法を用いて算出した。DOR は、Kaplan-Meier 法を用いて中央値を推定し、その95%信頼区間は、二重対数変換のBrookmeyer-Crowley 法を用いて算出した。TTR は、Kaplan-Meier 曲線を示し、投与群ごとにBOR がCR 又はPR である症例を対象に、要約統計量を算出した。
その他の評価項目: 各薬剤の投与状況として投与回数、治療期間、相対用量強度を薬剤別に集計した。後治療(薬物療法、放射線及び手術療法を含む)への移行率を投与群ごと及び化学療法レジメン(SOX、CapeOX)別に集計した。
サブグループ解析: 事前に規定された患者背景因子[ECOG PS、PD-L1 発現、実施国、性別、年齢、病変の部位、組織型、疾患状態、転移臓器の数、腹膜転移、肝転移、肺転移、化学療法レジメン]によるPFS、OSのサブグループ解析を行った。

1) 小野薬品工業 : 国際共同第Ⅱ/Ⅲ相(ONO-4538-37)試験成績(社内資料) 承認時評価資料
患者背景(全症例)
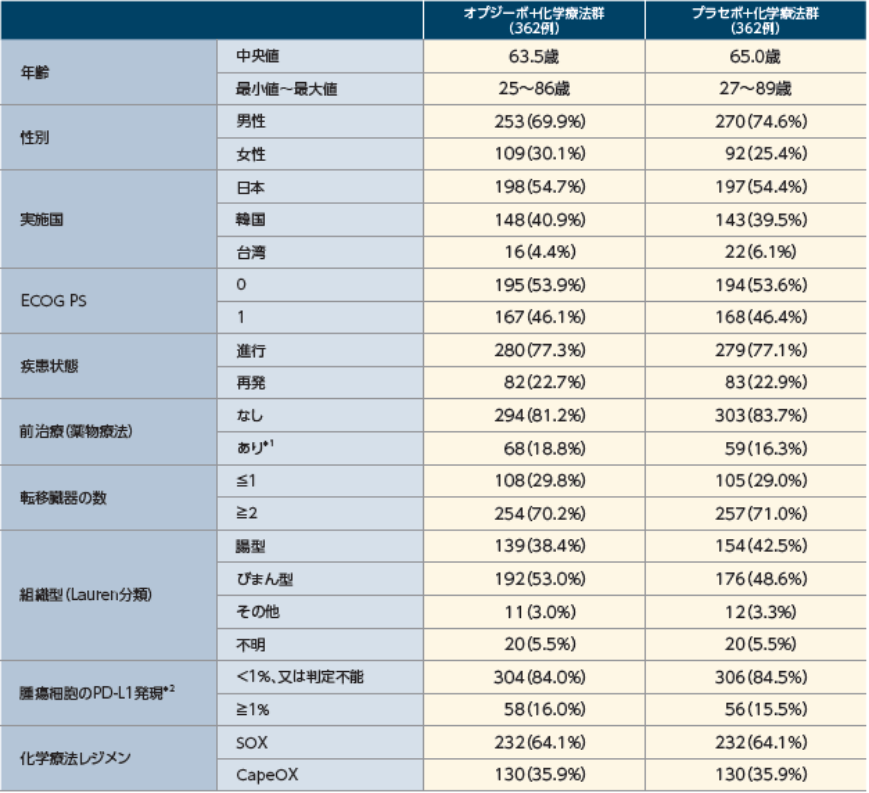
※1:術前又は術後補助化学療法
※2:TPS
有効性
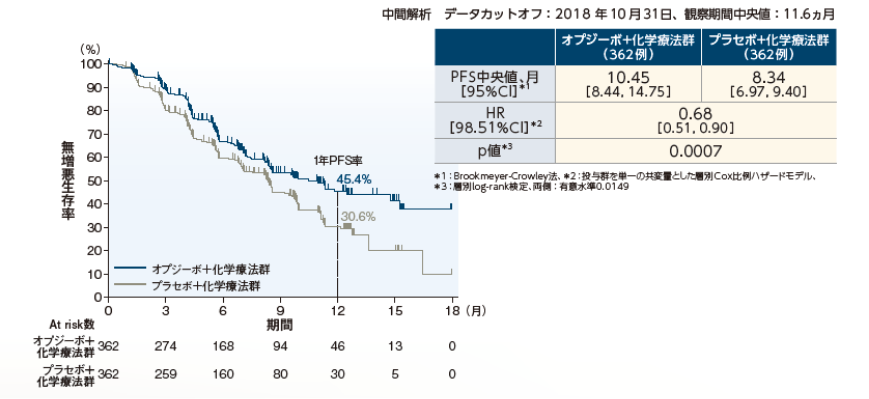
無増悪生存期間(PFS)中央値は、オプジーボ+化学療法群10.45ヵ月、プラセボ+化学療法群8.34ヵ月であり、オプジーボ+化学療法群のプラセボ+化学療法群に対する優越性が統計学的に検証されました※。オプジーボ+化学療法群のプラセボ+化学療法群に対するハザード比は0.68で、死亡又は増悪のリスクを32%低下させました。
※:p=0.0007(層別log-rank検定、両側:有意水準0.0149)
無増悪生存期間(PFS)[IRRC判定]〔 主要評価項目〕
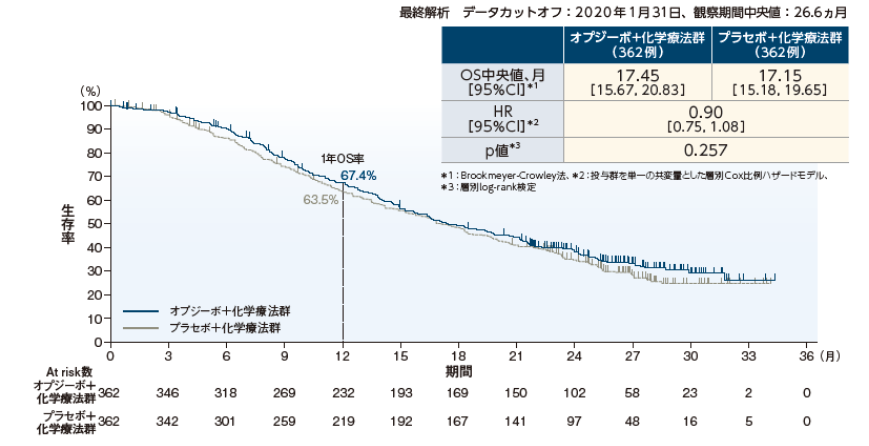
全生存期間(OS)中央値は、オプジーボ+化学療法群17.45ヵ月、プラセボ+化学療法群17.15ヵ月であり、オプジーボ+化学療法群のプラセボ+化学療法群に対する優越性を統計学的に検証できませんでした※。オプジーボ+化学療法群のプラセボ+化学療法群に対するハザード比は0.90でした。
※:p=0.257( 層別log-rank検定)
全生存期間(OS)〔 主要評価項目〕
奏効率(ORR)は、オプジーボ+化学療法群57.5%、プラセボ+化学療法群47.8%でした。
奏効率(ORR)/ 最良総合効果(BOR)/ 病勢制御率(DCR)/ 奏効に至るまでの期間(TTR)[IRRC 判定]〔 副次的評価項目〕
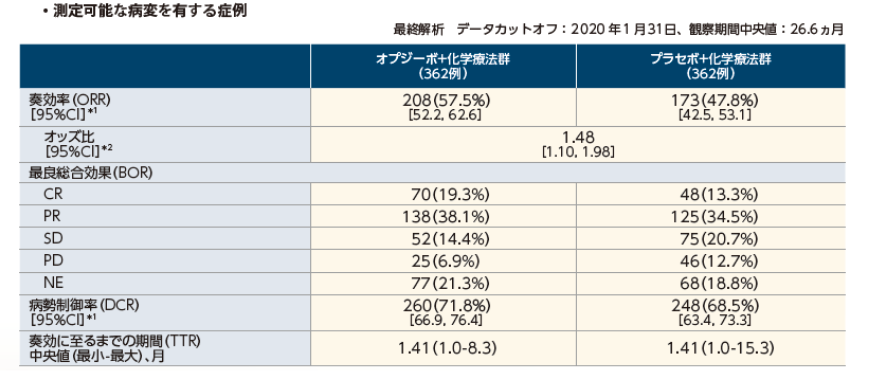
※1 : Clopper-Pearson法
※2 : PD-L1発現状況(TPS)、ECOG PS、疾患状態、実施国を層別因子としたCochran-Mantel-Haenszel法
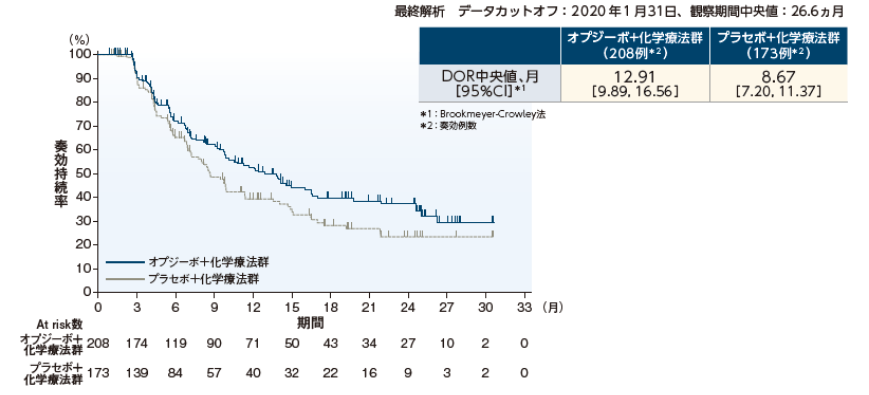
奏効期間(DOR)中央値は、オプジーボ+化学療法群12.91ヵ月、プラセボ+化学療法群8.67ヵ月でした。
奏効期間(DOR)[IRRC 判定]〔 副次的評価項目〕
安全性
副作用発現率は、オプジーボ+化学療法群97.8%、プラセボ+化学療法群97.5%、Grade 3-4の副作用発現率は、それぞれ57.1%と48.6%でした。
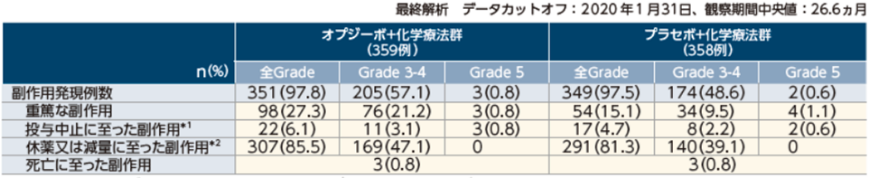
Grade 5の副作用は、オプジーボ+化学療法群で発熱性好中球減少症、突然死及び肝不全各1例(0.3%)、プラセボ+化学療法群で溶血性貧血、敗血症各1例(0.3%)でした。
※ 1 : オプジーボ/ プラセボ/S-1/ カペシタビンのいずれか1剤又は2剤以上が投与中止に至った有害事象又は副作用
※ 2 : オプジーボ/ プラセボ/ オキサリプラチン/S-1/ カペシタビンのいずれか1剤又は2剤以上が休薬又は減量に至った有害事象又は副作用
Grade 5は有害事象による死亡。なお、Grade 5は有害事象/副作用収集期間内にGrade 5になった事象であり、死亡に至った有害事象/副作用は、上記+期間内に発現して(期間内に死亡ではなく)のちに死亡に至った有害事象/副作用です。
いずれかの群で10%以上に発現した副作用
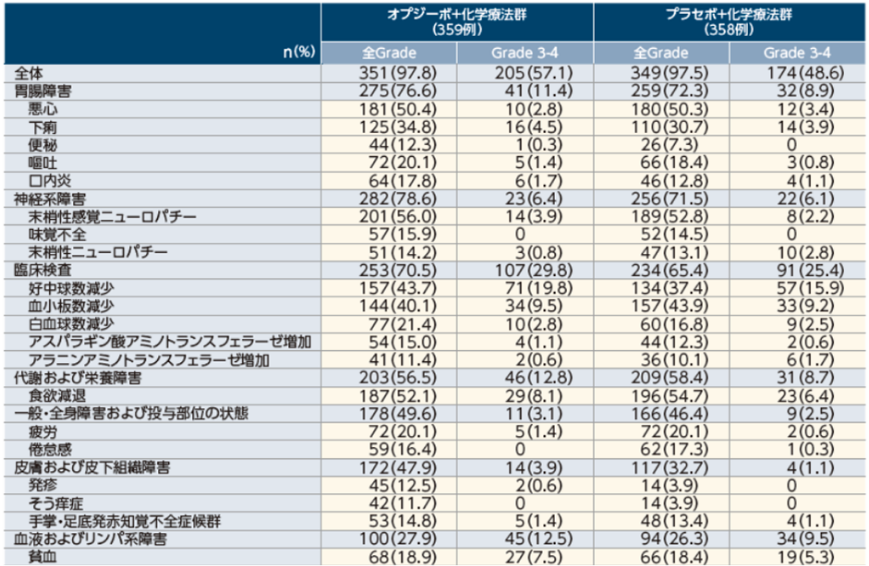
重篤な副作用/ 投与中止に至った副作用/ 死亡に至った副作用
主な重篤な副作用(2%以上)
オプジーボ+化学療法群:食欲減退5.0%(18例)
プラセボ+化学療法群:食欲減退2.8%(10例)
主な投与中止に至った副作用(2例以上)
オプジーボ+化学療法群:間質性肺疾患0.8%(3例)、末梢性感覚ニューロパチー0.6%(2 例)、疲労0.6%(2例)、食欲減退0.6%(2例)
プラセボ+化学療法群:下痢0.8%(3例)、間質性肺疾患0.8%(3例)、敗血症0.6%(2例)
死亡に至った副作用
オプジーボ+化学療法群:発熱性好中球減少症0.3%(1例)、突然死0.3%(1例)、肝不全 0.3%(1例)
プラセボ+化学療法群:溶血性貧血0.3%(1例)、敗血症0.3%(1例)、間質性肺疾患0.3%(1例)
事象名はMedDRA ver22.1Jを用いて読み替え、GradeはCTCAE v4.0を用いて評価しました。因果関係は、「関連あり」、「関連なし」の2段階で判定され、「関連あり」と判定された場合に、副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。また、発現頻度は、最終投与後28日(重篤な副作用の場合は100日)又は最終投与後の後治療開始のいずれか早い時点までに発現した副作用を対象に集計しました。
その他
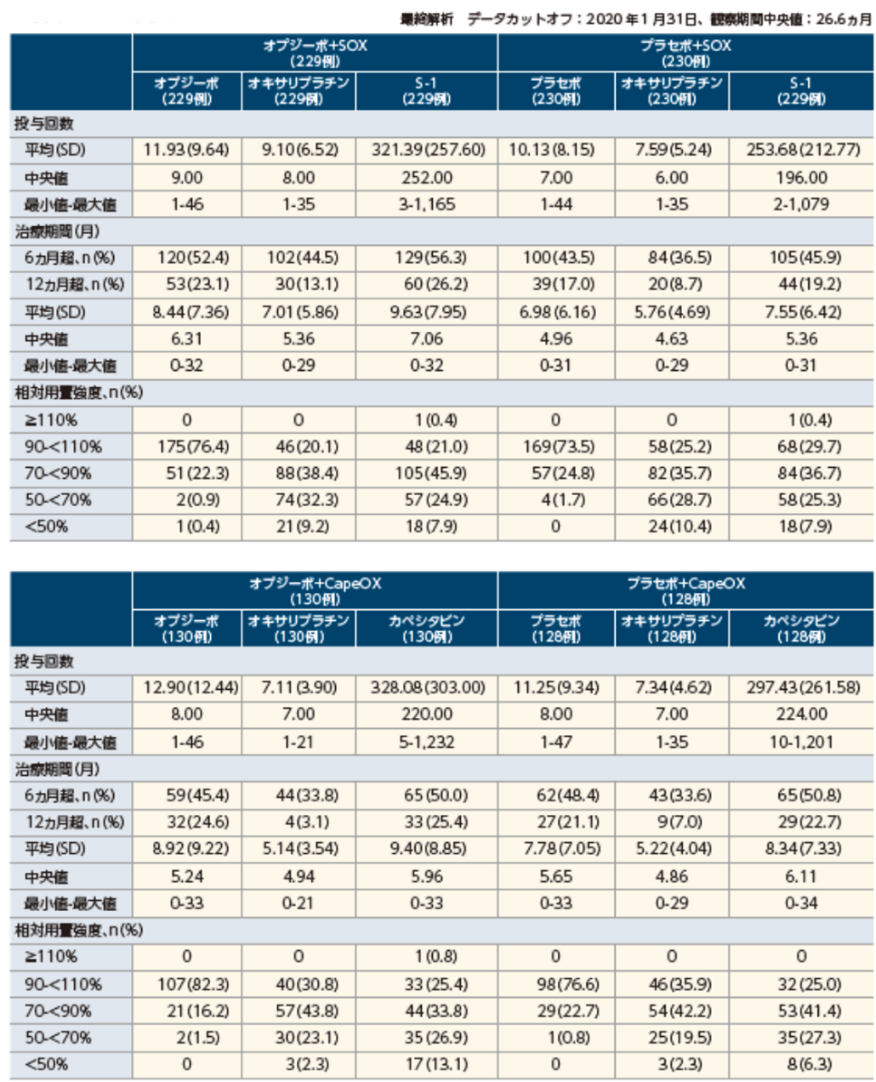
各薬剤の投与状況
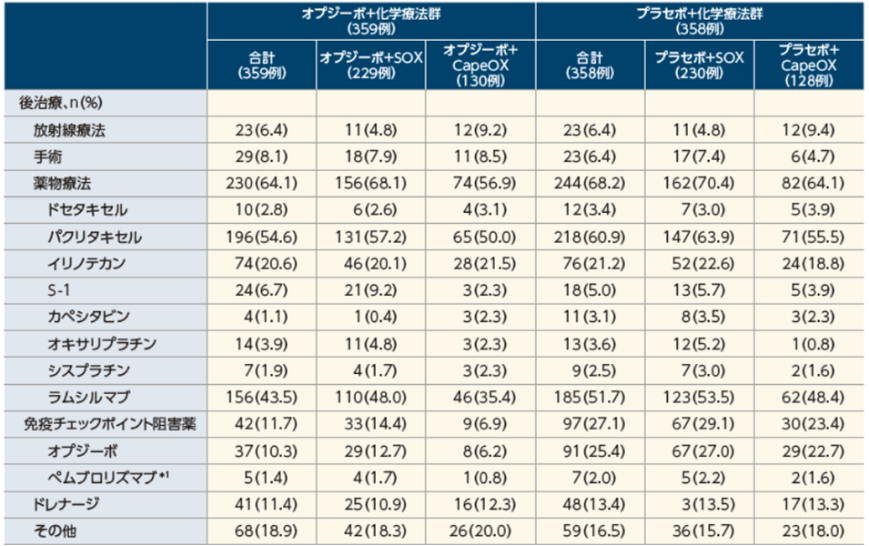
後治療(薬物療法、放射線療法及び手術療法を含む)への移行率
※1:本邦において胃癌の効能又は効果はないが、「がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する固形癌(標準的な治療が困難な場合に限る)」には効能又は効果を有する
4. 効能又は効果(一部抜粋)
治癒切除不能な進行・再発の胃癌
5.効能又は効果に関連する注意(一部抜粋)
<がん化学療法後に増悪した根治切除不能な進行・再発の食道癌>
5.17 本剤の一次治療における有効性及び安全性は確立していない。
6. 用法及び用量(一部抜粋)
<治癒切除不能な進行・再発の胃癌>
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
<効能共通>
7.1 本剤は、30分以上かけて点滴静注すること。
<治癒切除不能な進行・再発の胃癌>
7.9 他の抗悪性腫瘍剤と併用する場合には、HER2陰性の患者に投与すること。
7.10 他の抗悪性腫瘍剤との併用投与の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。
CPSについて、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤を併用する必要性について慎重に判断すること。[17.1.20参照]
7.11 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること。[17.1.20、17.1.21参照]

















