CheckMate 205試験(海外第Ⅱ相試験)概要
自家造血幹細胞移植の施行歴を有する古典的ホジキンリンパ腫患者を対象とした海外第Ⅱ相試験(CheckMate 205)(海外データ)5)
5)Armand P, et al. J Clin Oncol. 36(14): 1428-1439, 2018Reprinted
試験概要
試験概要
【目的】
自家造血幹細胞移植(ASCT)施行歴を有する古典的ホジキンリンパ腫に対するオプジーボ(ニボルマブ)の有効性及び安全性について検討する。
【試験デザイン】
多施設共同非盲検非対照第Ⅱ相試験
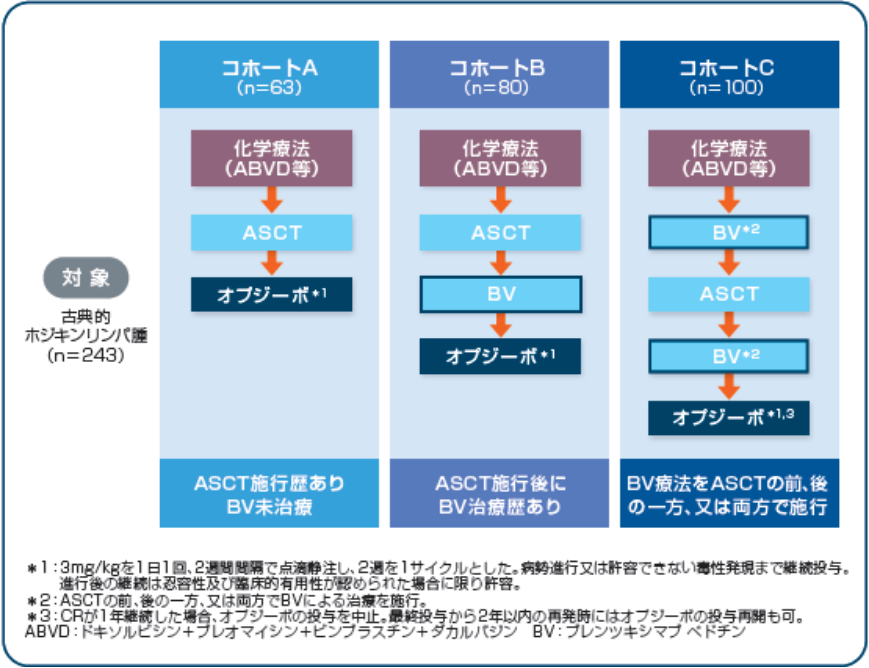
【対象】
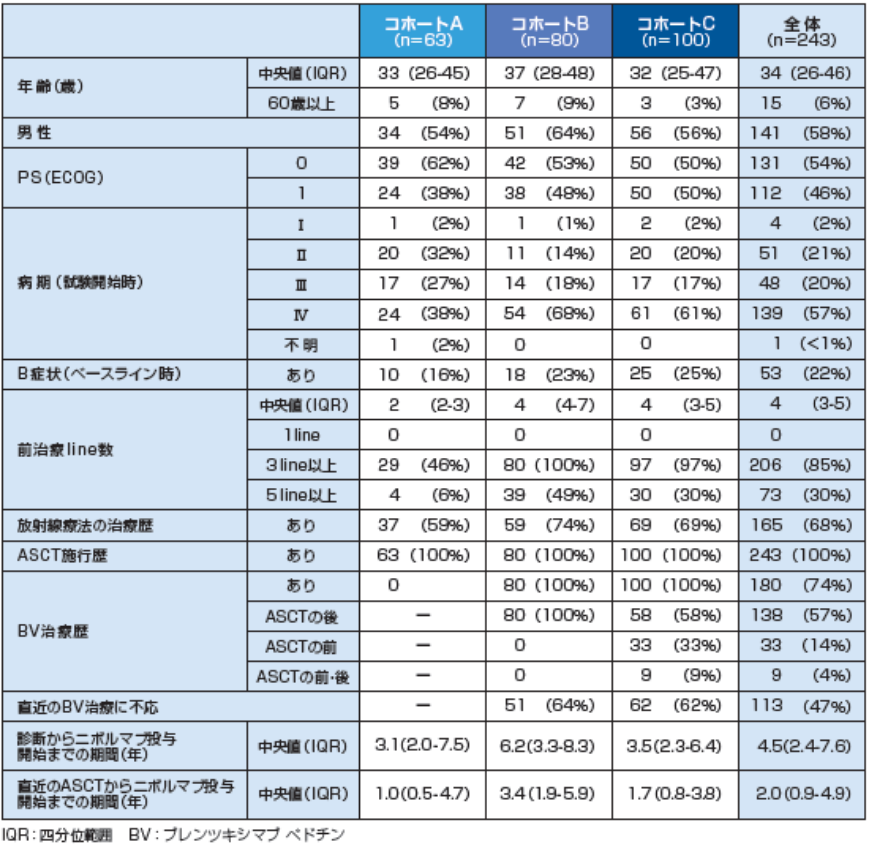
ASCT施行歴を有する古典的ホジキンリンパ腫患者 243例
コホートA( 63例):ブレンツキシマブ ベドチン未治療の患者
コホートB( 80例):ASCT施行後にブレンツキシマブ ベドチンの治療歴を有する患者
コホートC(100例):ASCT施行の前、後又はその両方にブレンツキシマブ ベドチンの治療歴を有する患者
【投与方法】
オプジーボ 3mg/kgを1日1回、2週間間隔で点滴静注し、2週を1サイクルとした。
【評価項目】
主要評価項目:各コホートにおける奏効率(ORR)[改訂IWG規準(2007)に基づく中央判定]※
副次的評価項目:CR率※、PR率※、奏効期間※など
探索的評価項目:無増悪生存期間(PFS)※、全生存期間(OS)など
【解析計画】
主要評価項目:抗腫瘍効果は、改訂IWG規準(2007)に基づき評価し、ORR及びその両側95%信頼区間(CI)(Clopper-Pearson法)を算出した。閾値奏効率は20%と設定した。
副次的評価項目:奏効期間は、Kaplan-Meier法を用いて中央値及びその95%CIを推定した。
探索的評価項目:PFS及びOSは、Kaplan-Meier法を用いて各解析項目の中央値及びその95%CIを推定した。さらに12ヵ月時点での生存率を同法を用いて推定した。
※:独立画像判定委員会(IRRC)による判定
本試験(CheckMate 205)は開発治験として実施され、その試験成績(データカットオフ:2015年10月)は国内での承認審査過程で評価を受けました[小野薬品工業:海外第Ⅱ相(CA209205)試験成績(社内資料)承認時評価資料]。
[利益相反] 本試験(CheckMate 205)はBristol-Myers Squibbの支援、資金提供により実施され、著者のうち、3名は同社の社員です。また、その他の著者には同社より謝礼金、研究費などを受領している者が含まれます。
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved.
Armand P, et al: J Clin Oncol. Vol .36(14), 2018: 1428 -1439.
有効性
奏効率(ORR)[ 中央判定:改訂IWG規準(2007)]〔主要評価項目〕
CR率、PR率[ 中央判定:改訂IWG規準(2007)]〔副次的評価項目〕
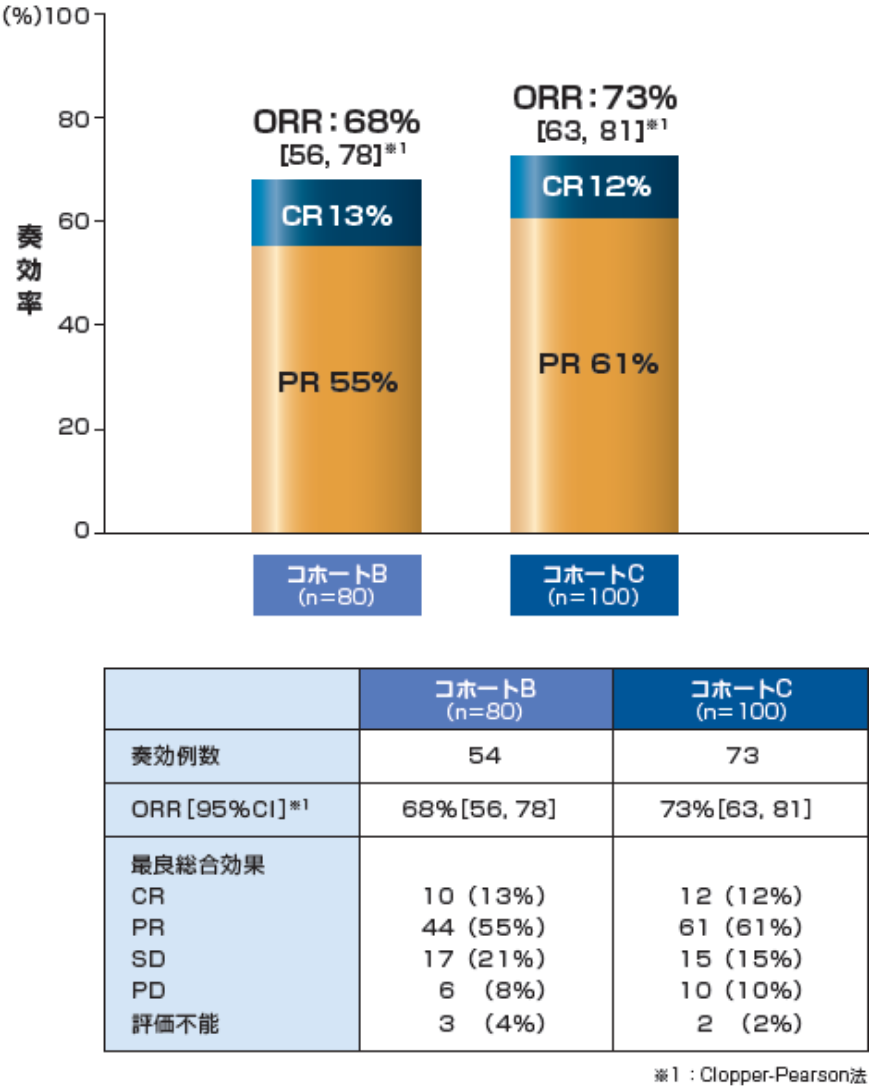
データカットオフ(2016年12月)時点での観察期間中央値は、コホートBが23ヵ月、コホートCが16ヵ月でした。
中央判定によるORRは、コホートBが68%(54/80例)[95%CI:56, 78]※1、コホートCが73%(73/100例)[95%CI:63, 81]※1でした。コホートB、CにおけるORRの95%CIの下限は、いずれも事前に設定した閾値奏効率20%を上回りました。
5)Armand P, et al. J Clin Oncol. 36(14): 1428-1439, 2018
奏効期間[ 中央判定:改訂IWG規準(2007)]〔副次的評価項目〕

奏効期間中央値は、コホートBが15.9ヵ月[95% CI:7.8, 20.3]※2、コホートCが14.5ヵ月[95%CI:9.5, 16.6]※2 でした。
無増悪生存期間(PFS) [ 中央判定:改訂IWG規準(2007)]〔探索的評価項目〕

PFS中央値は、コホートBが14.7ヵ月[95%CI:10.5, 19.6]※2、コホートCが11.9ヵ月[95% CI:11.1, 18.4 ]※2 でした。
全生存期間(OS) 〔探索的評価項目〕
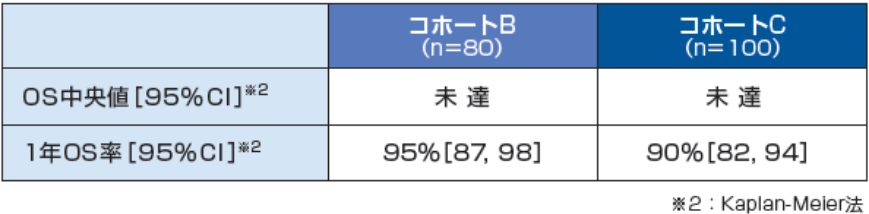
OS中央値は、コホートB、Cともに未達でした。
1年OS率は、コホートBが95%[95%CI:87, 98]※2、コホートCが90%[95%CI:82, 94]※2でした。
安全性
安全性(コホートA-C)5)
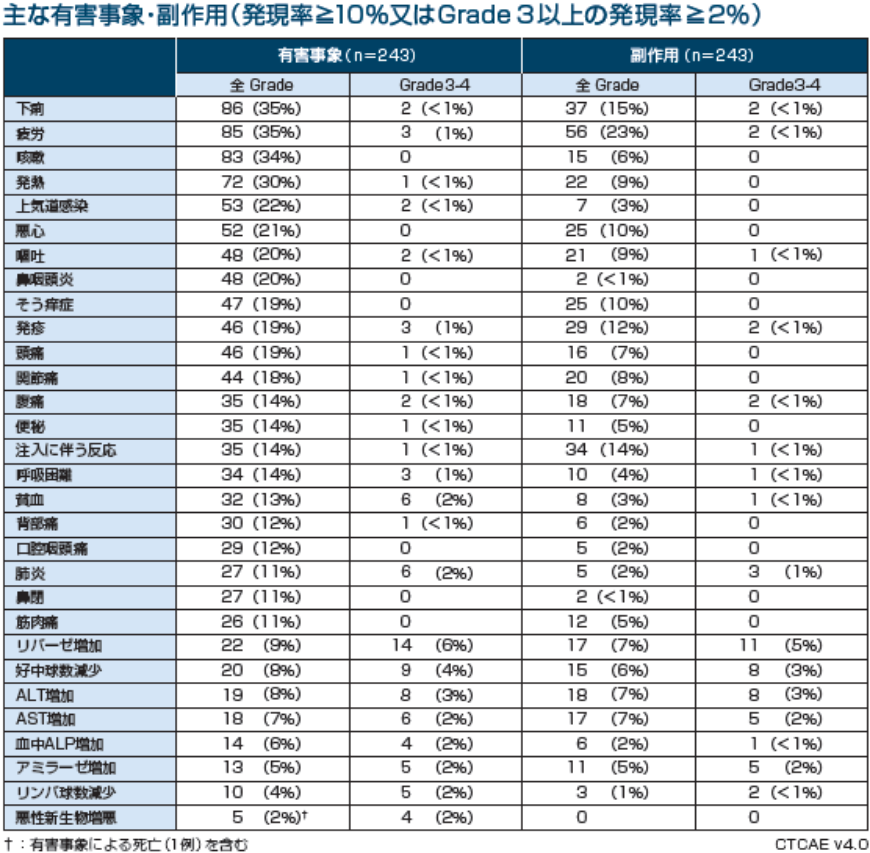
データカットオフ(2016年12月)時点で40%が治療継続中であり、観察期間中央値は18ヵ月でした。
主な副作用(10%以上)は、疲労56例(23%)、下痢37例(15%)、注入に伴う反応34例(14%)、発疹29例(12%)、悪心25例(10%)、そう痒症25例(10%)で、Grade 3以上の主な副作用(2%以上)は、リパーゼ増加11例(5%)、好中球数減少8例(3%)、ALT増加8例(3%)、AST増加5例(2%)、アミラーゼ増加5例(2%)でした。重篤な副作用は12%*1、投与中止に至った副作用は17例(7%)*2に認められました。なお、死亡に至った有害事象を3例*3に認めましたが、いずれも薬剤との因果関係は否定されました。
※1:注入に伴う反応(2%)、肺臓炎(1%)、肺炎(1%)、胸水(1%)、発熱(1%)など(論文中に発現例数の記載なし)
※2:肺臓炎(2%)、自己免疫性肝炎(1%)など
※3:多臓器障害+末梢性T細胞リンパ腫、悪性新生物増悪、心停止(各1例)
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved.
Armand P, et al: J Clin Oncol. Vol.36(14), 2018: 1428-1439.
5)Armand P, et al. J Clin Oncol. 36(14): 1428-1439, 2018
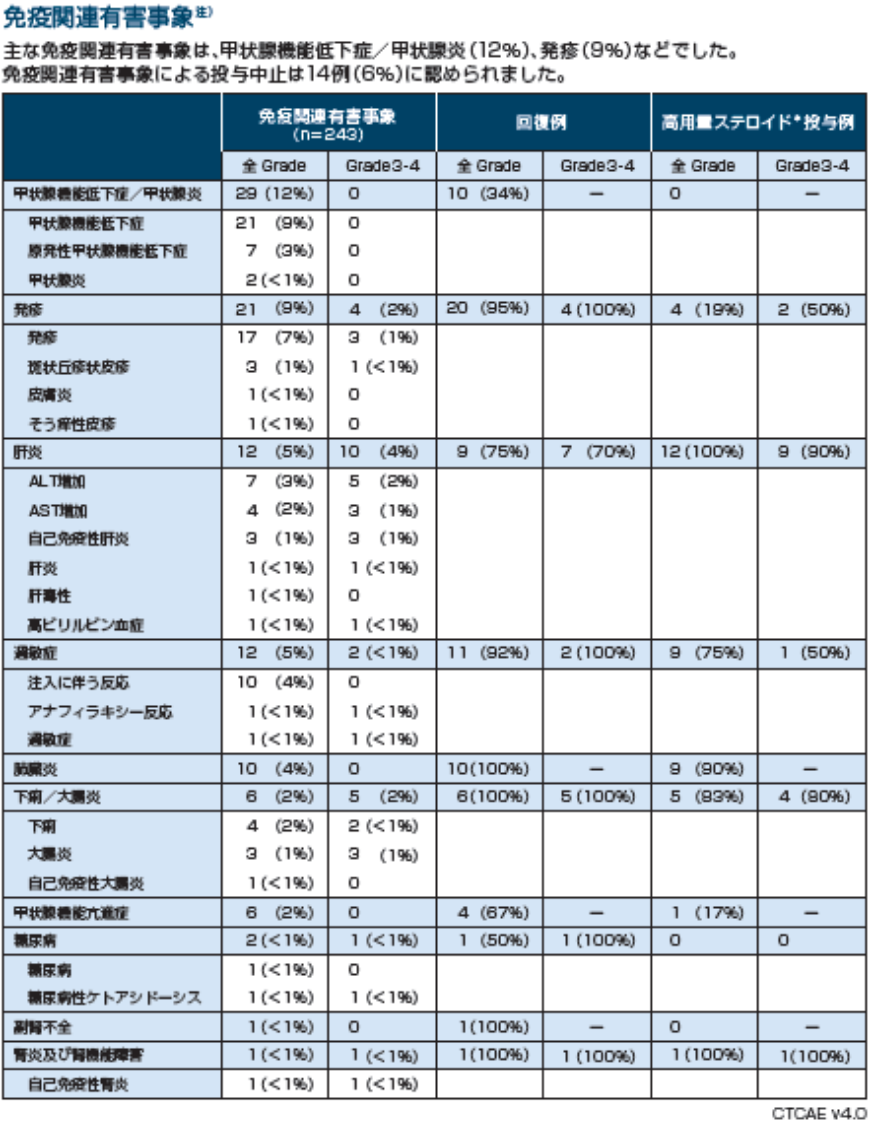
注)免疫調節薬の投与を要したすべての有害事象(内分泌系事象では例外あり)で、最終投与後100日までに報告されたもの
※:プレドニゾン換算40mg以上
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved.
Armand P, et al: J Clin Oncol. Vol . 36(14), 2018: 1428 -1439, Appendix.
Readers are encouraged to read the entire article and appendix for the correct context at jco.ascopubs.org.
その他
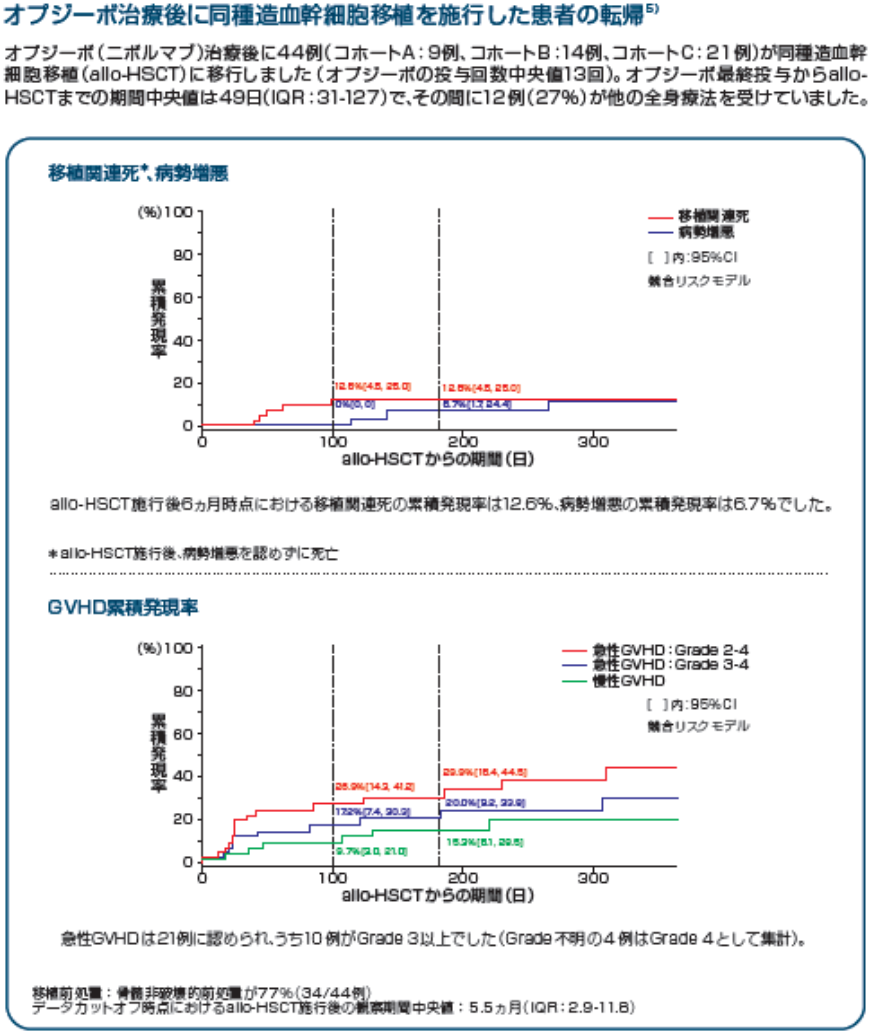
Adapted from Armand P, et al: J Clin Oncol. Vol.36(14), 2018: 1428-1439.
© 2018 American Society of Clinical Oncology. All rights reserved.
Readers are encouraged to read the entire article for the correct context at jco.ascopubs.org.
5) Armand P, et al. J Clin Oncol. 36(14): 1428-1439, 2018
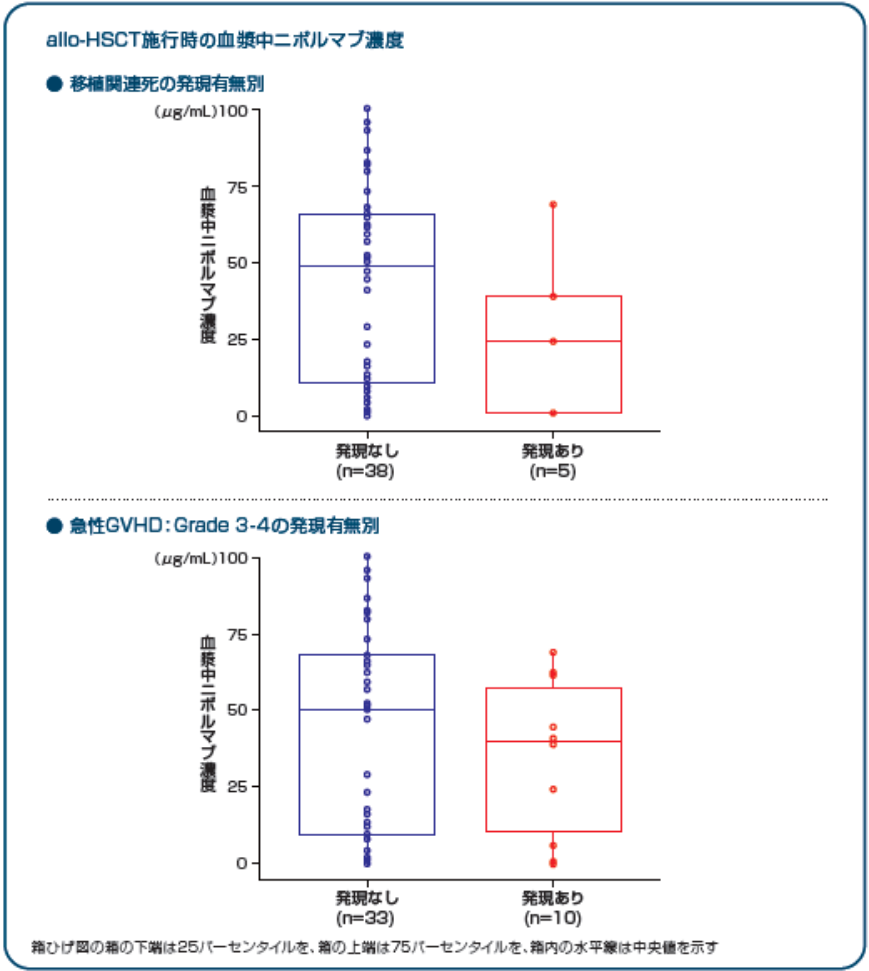
Reprinted with permission. © 2018 American Society of Clinical Oncology. All rights reserved.
Armand P, et al: J Clin Oncol. Vol . 36(14), 2018: 1428 -1439, Appendix.
Readers are encouraged to read the entire article and appendix for the correct context at jco.ascopubs.org.
4. 効能又は効果(一部抜粋)
再発又は難治性の古典的ホジキンリンパ腫
5. 効能又は効果に関連する注意(一部抜粋)
〈再発又は難治性の古典的ホジキンリンパ腫〉
5.11「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
6. 用法及び用量(一部抜粋)
〈再発又は難治性の古典的ホジキンリンパ腫〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔で点滴静注する。
9. 特定の背景を有する患者に関する注意
9.1.3 臓器移植歴(造血幹細胞移植歴を含む)のある患者
本剤の投与により移植臓器に対する拒絶反応又は移植片対宿主病が発現するおそれがある。

















