CheckMate 141試験(国際共同第Ⅲ相試験)概要
試験概要
試験デザイン1,2)

【除外基準】 ・活動性の脳転移又は髄膜転移を有する患者 ・上咽頭癌、原発不明の扁平上皮癌、唾液腺癌
【目的】
プラチナ抵抗性の再発又は転移性頭頸部扁平上皮癌を対象にオプジーボ群の治験医師選択治療(IC)群に対する有効性及び安全性を検討する。
【対象】
プラチナ抵抗性の再発又は転移性頭頸部扁平上皮癌患者361例(アジア人34例)[オプジーボ群:240例(アジア人23例)、IC群:121例(アジア人11例)]
【評価項目】
主要評価項目:全生存期間(OS)、副次的評価項目:無増悪生存期間(PFS)、奏効率(ORR)、探索的評価項目:奏効に至るまでの期間(TTR)、奏効期間(DOR)など
【解析計画】
主要評価項目:OSは、セツキシマブの治療歴の有無を層別因子とした層別log-rank検定を用いて投与群間を比較した。なお、中間解析では、有意水準(両側)を0.0227として優越性を検証した。また、ハザード比とその両側97.73%信頼区間は、投与群を単一の共変量として上記因子を層別因子とした層別Cox比例ハザードモデルを用いて推定した。OSのイベント発生までの分布は、全生存率とともにKaplan-Meier法を用いて推定し、95%信頼区間のKaplan-Meier推定値を提示した。生存率は、12、24ヵ月時点を推定した。また、OSの中間解析は、少なくとも195件(70%)のOSイベントが観測された後に実施した。2年フォローアップ時のOSのハザード比とその両側95%信頼区間は、Cox比例ハザードモデルを用いて推定した。
副次的評価項目:副次的評価項目における比較については、第Ⅰ種の過誤確率が0.05に保たれるようhierarchical testing
procedureを用いて検定を行った。IC群と比較してオプジーボ群で統計学的に有意なOSの延長が認められた場合、PFSについて有意水準(両側)0.05を用いて投与群間の比較を行い、IC群と比較してオプジーボ群で統計学的に有意なPFSの改善が認められた場合、ORRについて有意水準(両側)0.05を用いて投与群間の比較を行うこととした。PFSは、OSと同様の層別因子及び検定法を用いて投与群間を比較し、ハザード比とその両側95%信頼区間は、投与群を単一の共変量として上記因子を層別因子とした層別Cox比例ハザードモデルを用いて推定した。PFSのイベント発生までの分布は、無増悪生存率(12、24ヵ月無増悪生存率含む)とともにKaplan-Meier法を用いて推定し、95%信頼区間のKaplan-Meier推定値を提示した。無作為化後に経時的に腫瘍径の変化を測定し、最良総合効果(BOR)は、RECISTガイドライン1.1版を用いて試験実施施設の医師が評価した。ORR及びその両側95%信頼区間は、Clopper-Pearson法を用いて算出した。
探索的評価項目:TTRは、BORがPR以上と判定された症例に限定して解析を行った。DORは、奏効が認められた症例で評価を行った。
サブグループ解析:解析計画の有効性で設定された評価項目において規定された日本人部分集団及びアジア人集団を対象としたサブグループ解析を行った。
*1:本邦におけるセツキシマブの用法及び用量に関連する注意(一部抜粋)は、「〈頭頸部癌〉7.7 本剤は、放射線療法又は他の抗悪性腫瘍剤と併用すること。」である
*2:本邦におけるメトトレキサート通常療法による効能・効果は、「下記疾患の自覚的並びに他覚的症状の緩解:急性白血病、慢性リンパ性白血病、慢性骨髄性白血病、絨毛性疾患(絨毛癌、破壊胞状奇胎、胞状奇胎)」、用法・用量(一部抜粋)は、「(急性白血病、慢性リンパ性白血病、慢性骨髄性白血病)メトトレキサートとして、通常、成人5~10mgを1日量として、1週間に3~6回注射する。」もしくは、「(絨毛性疾患)1クールを5日間とし、メトトレキサートとして、通常、成人1日10~30mgを注射する。」である
*3:本邦におけるドセタキセルの用法及び用量は、「通常、成人に1日1回、ドセタキセルとして60mg/m2(体表面積)を1時間以上かけて3~4週間間隔で点滴静注する。なお、患者の状態により適宜増減すること。ただし、1回最高用量は75mg/m2とする。」である
アジア人集団の内訳2)
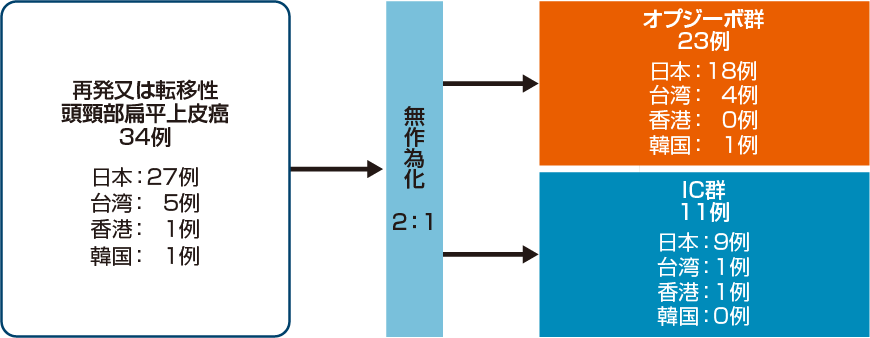
アジア人集団は、日本、台湾、香港、韓国に籍を有する症例とし、これらの国以外で登録されたアジア人は含まれない
1)Yen CJ, et al. Head Neck. 2020; 42: 2852-2862.
[利益相反]本試験は、小野薬品工業及びBristol-Myers
Squibbからの資金提供をうけて実施された。また、著者のなかに同社より助成金などを受領しているものが含まれ、1名は小野薬品工業、1名はBristol-Myers Squibbの社員である。
2)Kiyota N, et al. Oral Oncol. 2017; 73: 138-146.
[利益相反]本試験は、小野薬品工業からの資金提供をうけて実施された。また、著者のなかに同社及びBristol-Myers
Squibbより助成金などを受領しているものが含まれ、1名は小野薬品工業、2名はBristol-Myers Squibbの社員である。
患者背景
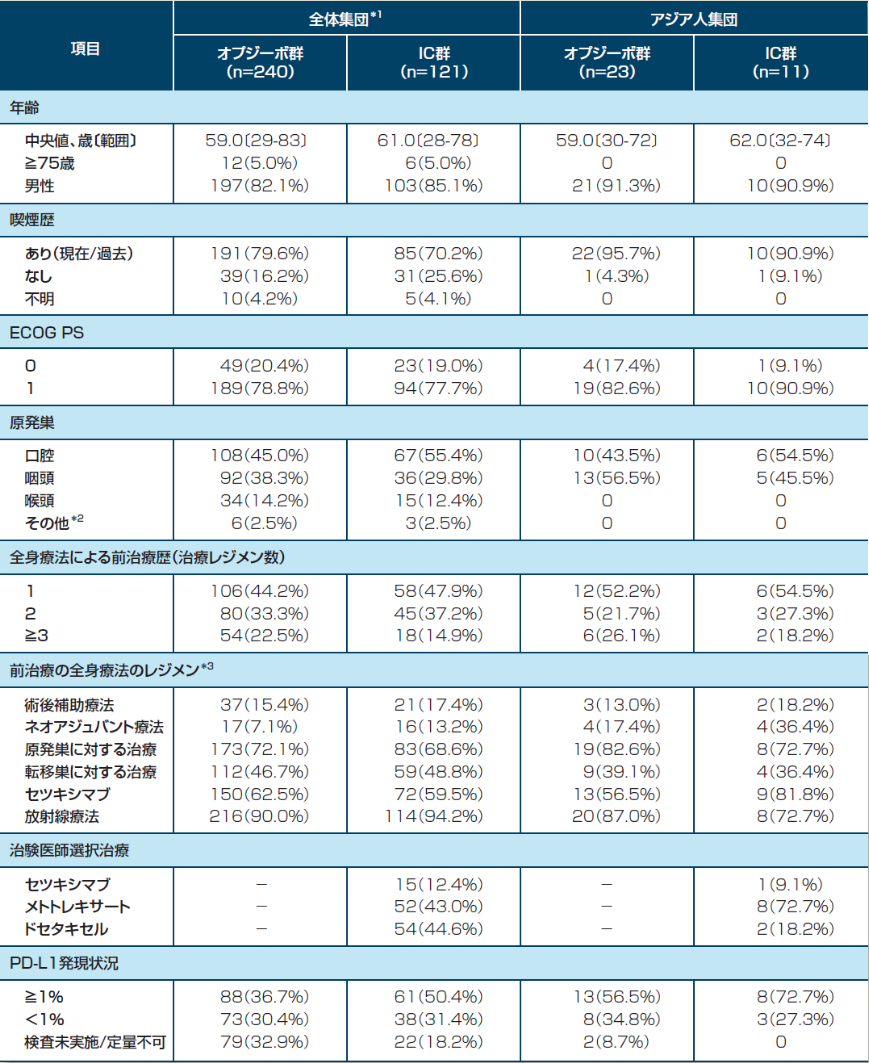
*1:全体集団にはアジア人が含まれる *2:その他のカテゴリーには、2つ以上の腫瘍を持つ症例が含まれる(例:喉頭、口腔又は咽頭) *3:一部の患者は2つ以上の前治療歴を有する
Kiyota N, et al. Oral Oncol. 2017; 73: 138-146.
*1:全体集団にはアジア人が含まれる *2:その他のカテゴリーには、2つ以上の腫瘍を持つ症例が含まれる(例:喉頭、口腔又は咽頭) *3:一部の患者は2つ以上の前治療歴を有する
Kiyota N, et al. Oral Oncol. 2017; 73: 138-146.
有効性
全生存期間(OS)[主要評価項目・サブグループ解析]
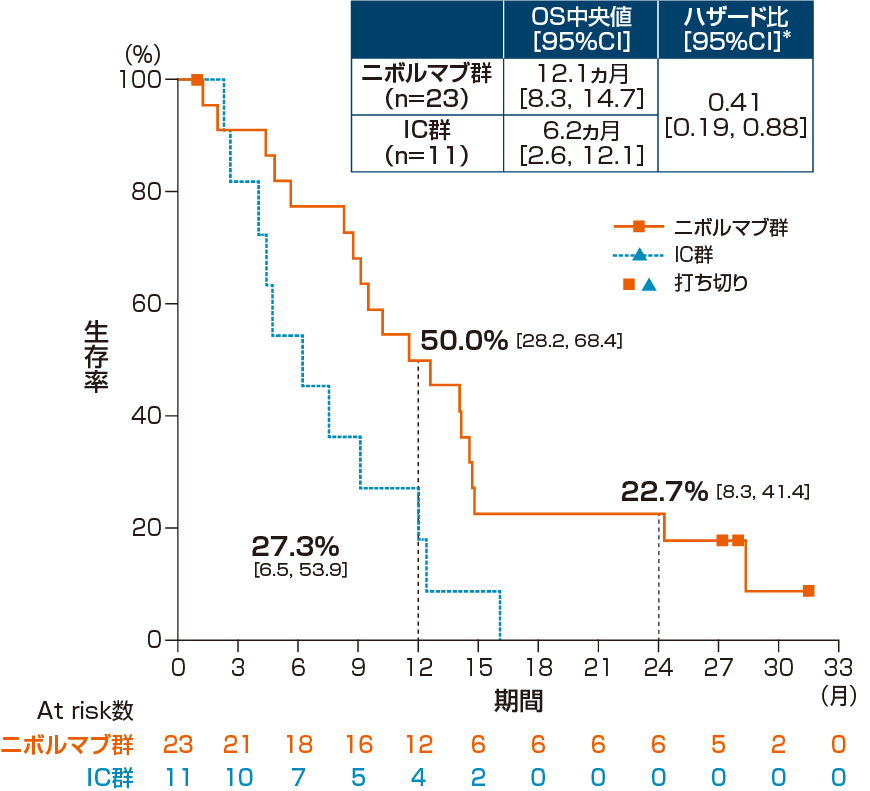
2年フォローアップにおけるアジア人集団のOS中央値は、オプジーボ群12.1ヵ月、IC群6.2ヵ月であり、オプジーボ群のIC群に対するハザード比は0.41(95%信頼区間:0.19, 0.88)*でした。
1年生存率は、オプジーボ群50.0%、IC群27.3%で、2年生存率は、オプジーボ群22.7%でした。
*:Cox比例ハザードモデル
全生存期間(OS)[主要評価項目]
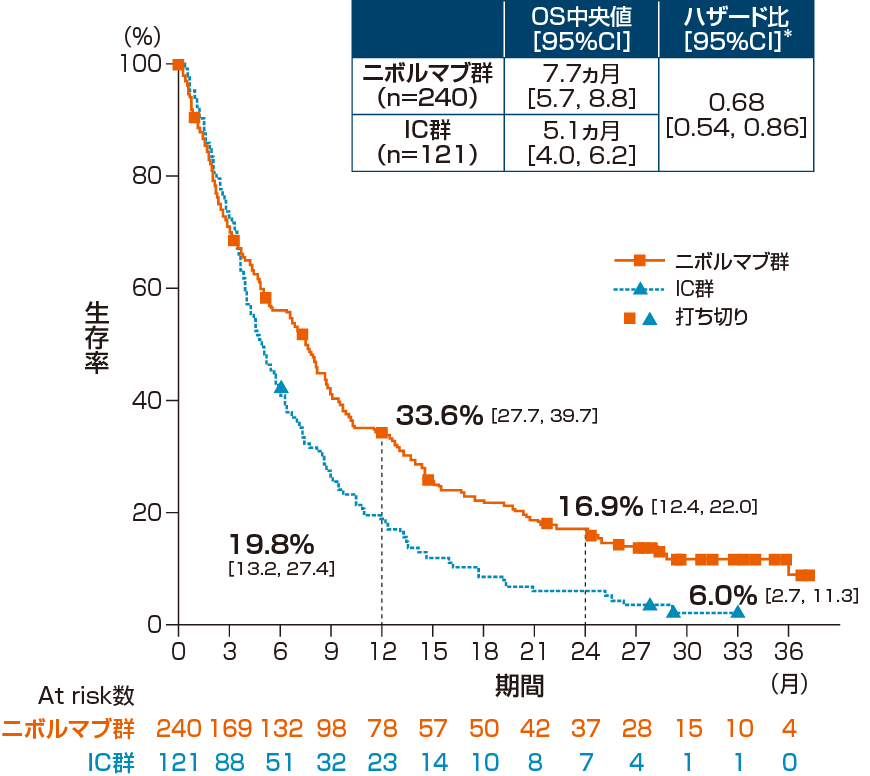
2年フォローアップにおける全体集団のOS中央値は、オプジーボ群7.7ヵ月、IC群5.1ヵ月であり、オプジーボ群のIC群に対するハザード比は0.68(95%信頼区間:0.54,0.86)*でした。
1年生存率は、オプジーボ群33.6%、IC群19.8%で、2年生存率は、オプジーボ群16.9%、IC群6.0%でした。
*:Cox比例ハザードモデル
無増悪生存期間(PFS)[副次的評価項目・サブグループ解析]
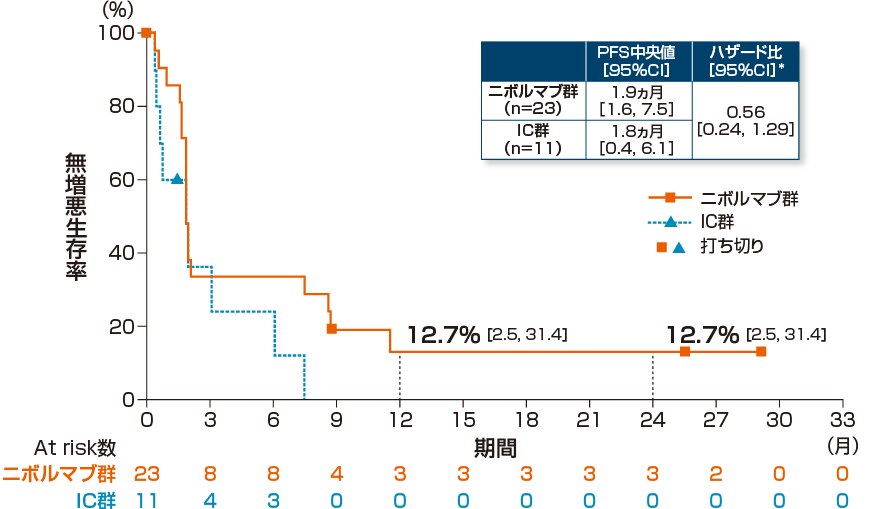
アジア人集団におけるPFS中央値は、オプジーボ群1.9ヵ月、IC群1.8ヵ月であり、オプジーボ群のIC群に対するハザード比は0.56(95%信頼区間:0.24, 1.29)*でした。
オプジーボ群の1年PFS率及び2年PFS率はいずれも12.7%でした。
*:Cox比例ハザードモデル
抗腫瘍効果:奏効率(ORR)[副次的評価項目・サブグループ解析]
奏効に至るまでの期間(TTR)/奏効期間(DOR)[探索的評価項目・サブグループ解析]
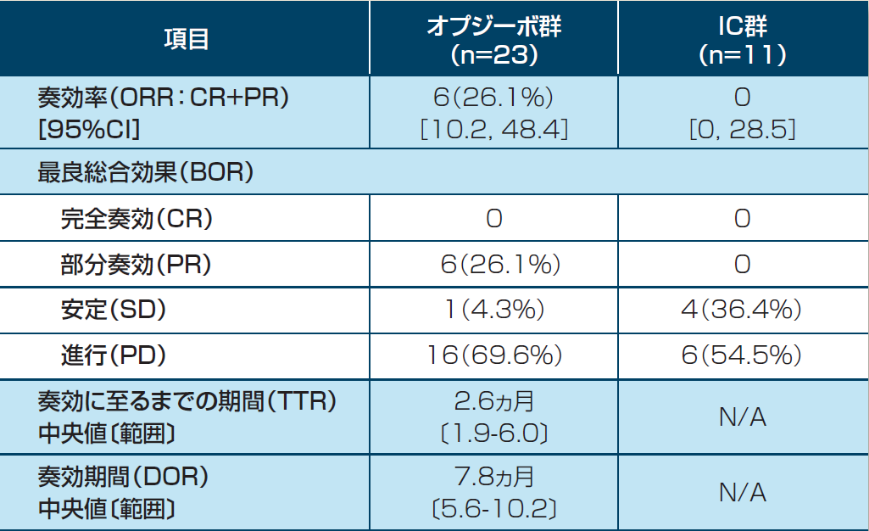
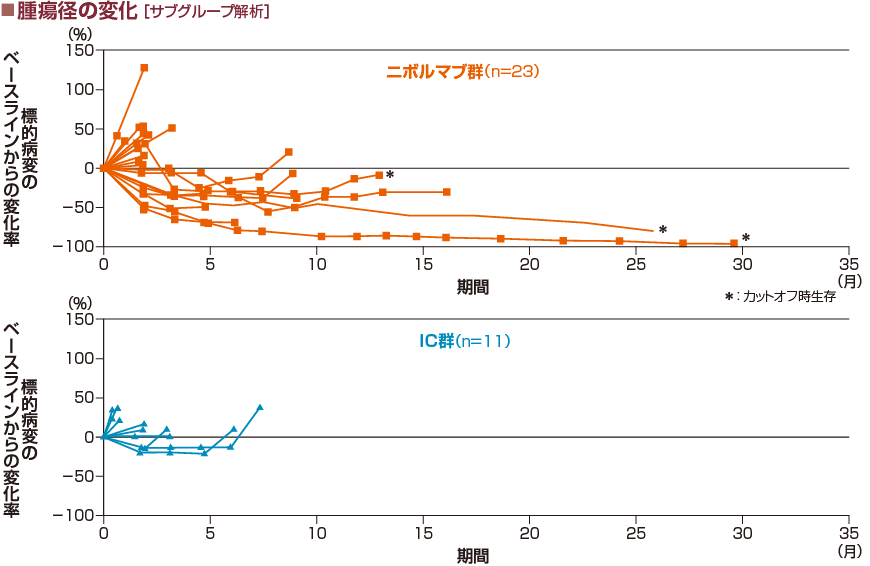
アジア人集団におけるORRは、26.1%(6/23例)(95%信頼区間:10.2, 48.4)でした。
奏効例の6例のうち4例はオプジーボの後治療で化学療法(分子標的薬含む)が施行されました。
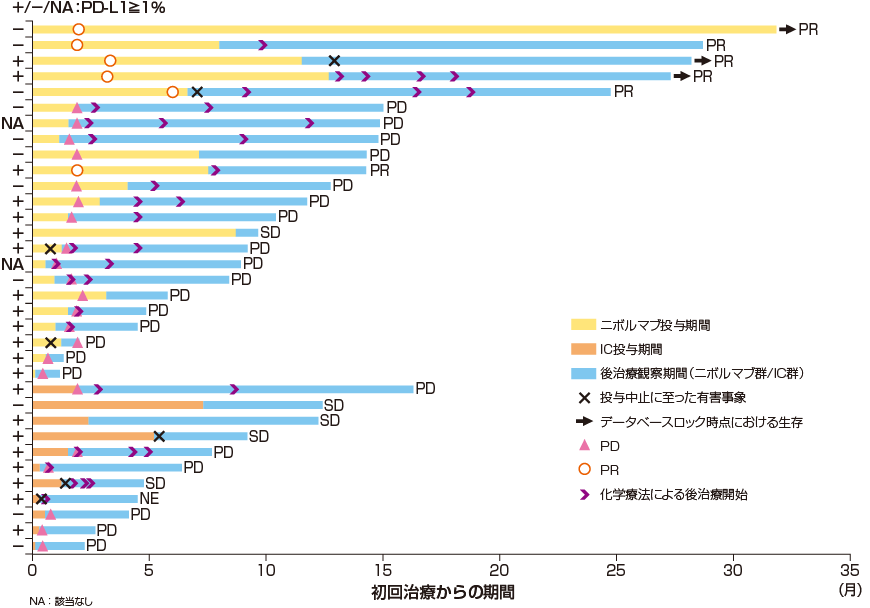
治療経過及び転帰
安全性
いずれかの群で10%以上に発現した副作用/留意すべき副作用
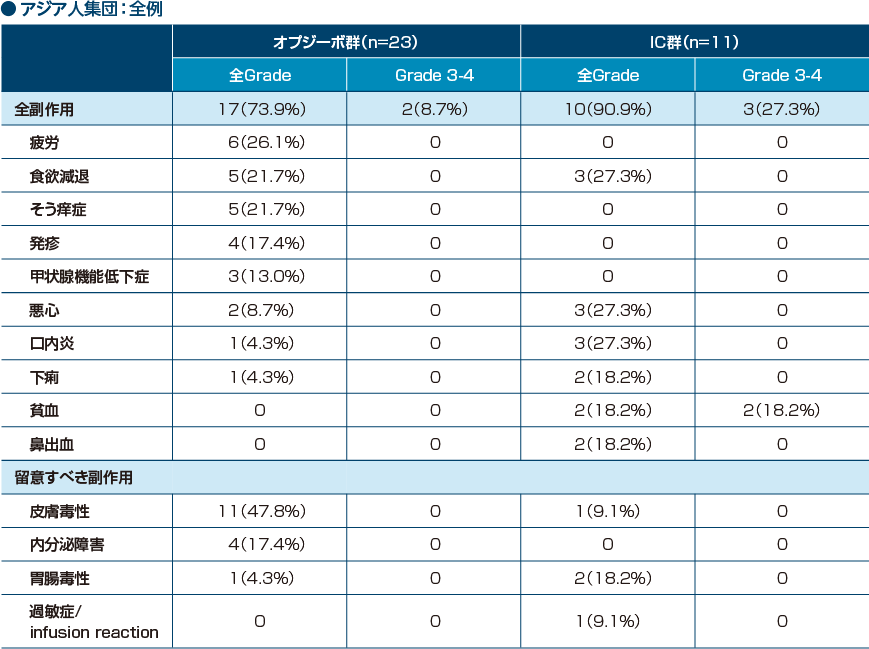
アジア人集団において、オプジーボ群の主な副作用(10%以上)は、疲労、食欲減退、そう痒症、発疹、甲状腺機能低下症でした。
4. 効能又は効果(一部抜粋)
再発又は遠隔転移を有する頭頸部癌
6. 用法及び用量(一部抜粋)
〈再発又は遠隔転移を有する頭頸部癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。

















