CheckMate 238 試験(国際共同第Ⅲ相試験)概要
完全切除後のⅢB-Ⅳ期の悪性黒色腫を対象として、オプジーボの有効性・安全性を検討した国際共同第Ⅲ相試験1,2)
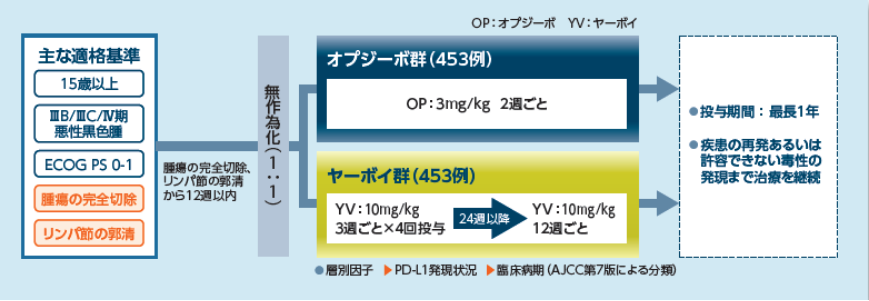
試験概要
試験デザイン
小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-21/CA209238)試験成績(社内資料) 承認時評価資料より作図
Ascierto PA, et al. Lancet Oncol. 2020; 21: 1465-1477. より作図
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
データベースロック日:2020年1月30日
観察期間中央値:オプジーボ群 51.1ヵ月、ヤーボイ群 51.9ヵ月
【目的】
完全切除後の再発リスクが高いⅢB/ⅢC/Ⅳ期の悪性黒色腫を対象として、ヤーボイ群に対するオプジーボ群の優越性を検証し、安全性を検討する。
【試験デザイン】
国際共同二重盲検無作為化第Ⅲ相比較試験[優越性試験]
【対象】
完全切除後の再発リスクが高いⅢB/ⅢC/Ⅳ期の悪性黒色腫患者 906例
(オプジーボ群:453例、ヤーボイ群:453例)
【投与方法】
オプジーボ群:オプジーボ3mg/kgを1日1回、2週間間隔で点滴静注した。 ヤーボイ群:ヤーボイ10mg/kgを1日1回、3週間間隔で4回点滴静注し、その後は12週間間隔で点滴静注した。
評価項目
主要評価項目:無再発生存期間(RFS)
副次的評価項目:PD-L1発現状況別のRFS
全生存期間(OS)
安全性
健康関連QOLに関する評価 等
探索的評価項目:無遠隔転移生存期間(DMFS) 等
【解析計画】
(一部抜粋)
主要評価項目:無再発生存期間(RFS)
有意水準0.05(両側)で優越性検定を行った。RFSの中間解析はすべての被験者が18ヵ月以上の追跡調査を受けた時点で、最終解析は36ヵ月以上の追跡調査を受けた時点で実施することとした。無作為化された被験者を対象に、スクリーニング時のPD-L1発現状況及び病期による層別log-rank検定(両側)を用いて解析した。
オプジーボ群のヤーボイ群に対するハザード比とその両側95%信頼区間は、投与群を単一の因子、音声自動応答システム(IVRS)で記録した層別割付の情報を層別因子としたCox比例ハザードモデルを用いて算出した。RFS曲線、RFS中央値とその95%信頼区間、6、12、18、48ヵ月時点のRFS率及びその95%信頼区間は、Kaplan-Meier法を用いて推定した。
副次的評価項目:PD-L1発現状況別の無再発生存期間(RFS)、全生存期間(OS) RFSに関して、上記因子を層別因子としたCox比例ハザードモデルを用いてPD-L1発現状況(カットオフ値:1%、5%、10%)と投与群との交互作用の検定を行った。さらに、PD-L1発現状況(カットオフ値:1%、5%、10%)で層別化した部分集団ごとに、ハザード比とその95%信頼区間の推定を行った。RFS曲線、RFS中央値及び対応する95%信頼区間はKaplan-Meier法を用いて推定した。OSに関して、オプジーボ群のヤーボイ群に対するハザード比とその95%信頼区間は、上記因子を層別因子としたCox比例ハザードモデルを用いて推定した。OS曲線、OS中央値及び対応する95%信頼区間、並びに6、12、18、48ヵ月時点のOS率とその95%信頼区間はKaplan-Meier法を用いて推定した。
探索的評価項目:無遠隔転移生存期間(DMFS)
登録時にⅢB/ⅢC期の無作為化された被験者を対象に、スクリーニング時のPD-L1発現状況による層別log-rank検定(両側)により解析した。ハザード比とその両側95%信頼区間は、上記因子を層別因子としたCox比例ハザードモデルを用いて推定した。DMFS曲線、DMFS中央値及び対応する95%信頼区間、並びに6、12、18、48ヵ月時点のDMFS率とその95%信頼区間を、Kaplan-Meier法を用いて推定した。
サブグループ解析:RFS及びDMFSの全症例の結果に対して、年齢、性別、人種、ベースラインの病期、PD-L1発現状況、悪性黒色腫のサブタイプ、BRAF遺伝子変異状況、地域を層別因子としてサブグループ解析を実施した。
1) 小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-21/CA209238)試験成績(社内資料) 承認時評価資料
2) Ascierto PA, et al. Lancet Oncol. 2020; 21: 1465-1477.
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
患者背景
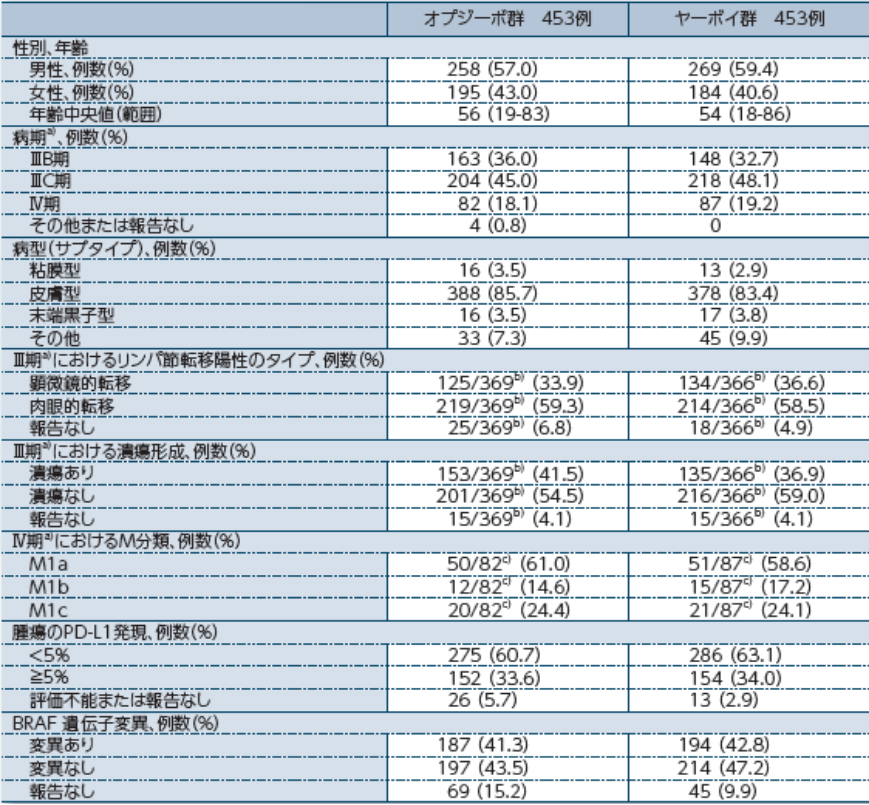
a)AJCC病期分類(第7版) b)Ⅲ期の症例が対象 c)Ⅳ期の症例が対象
1) 小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-21/CA209238)試験成績(社内資料) 承認時評価資料
有効性
無再発生存期間(RFS)【主要評価項目】
〔RFSのKaplan-Meier曲線〕
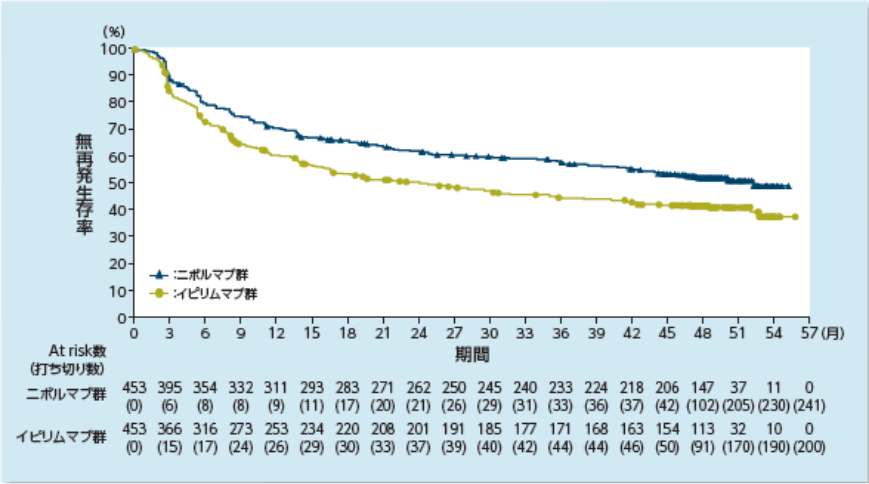
2)Ascierto PA, et al. Lancet Oncol. 2020; 21: 1465-1477.

NR:not reached a)Kaplan-Meier法 b)Cox比例ハザードモデル(層別因子:PD-L1発現状況、臨床病期) c)層別log-rank検定(層別因子:PD-L1発現状況、臨床病期)
全生存期間(OS)【副次的評価項目】
〔OSのKaplan-Meier曲線〕
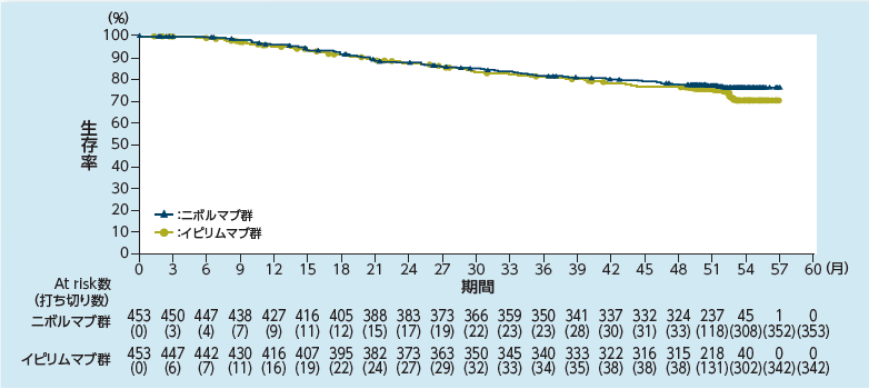
2)Ascierto PA, et al. Lancet Oncol. 2020; 21: 1465-1477.
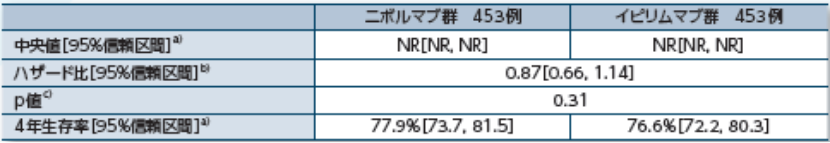
無遠隔転移生存期間(DMFS)【探索的評価項目】
〔DMFSのKaplan-Meier曲線〕
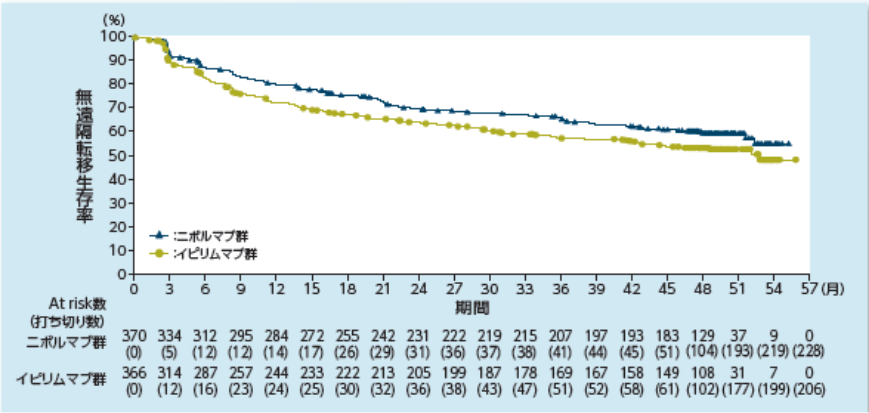
2)Ascierto PA, et al. Lancet Oncol. 2020; 21: 1465-1477.
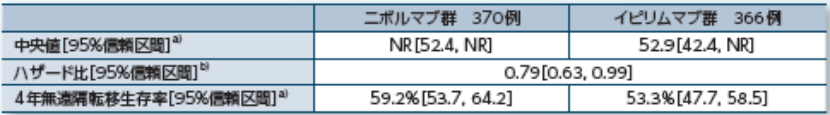
NR:not reached a)Kaplan-Meier法 b)Cox比例ハザードモデル(層別因子:PD-L1発現状況、臨床病期) c)層別log-rank検定(層別因子:PD-L1発現状況、臨床病期)
4年時点における無再発生存期間中央値(95%信頼区間)a)はオプジーボ群52.4ヵ月(42.5, NR)、ヤーボイ群24.1ヵ月(16.6, 35.1)でした2)
安全性
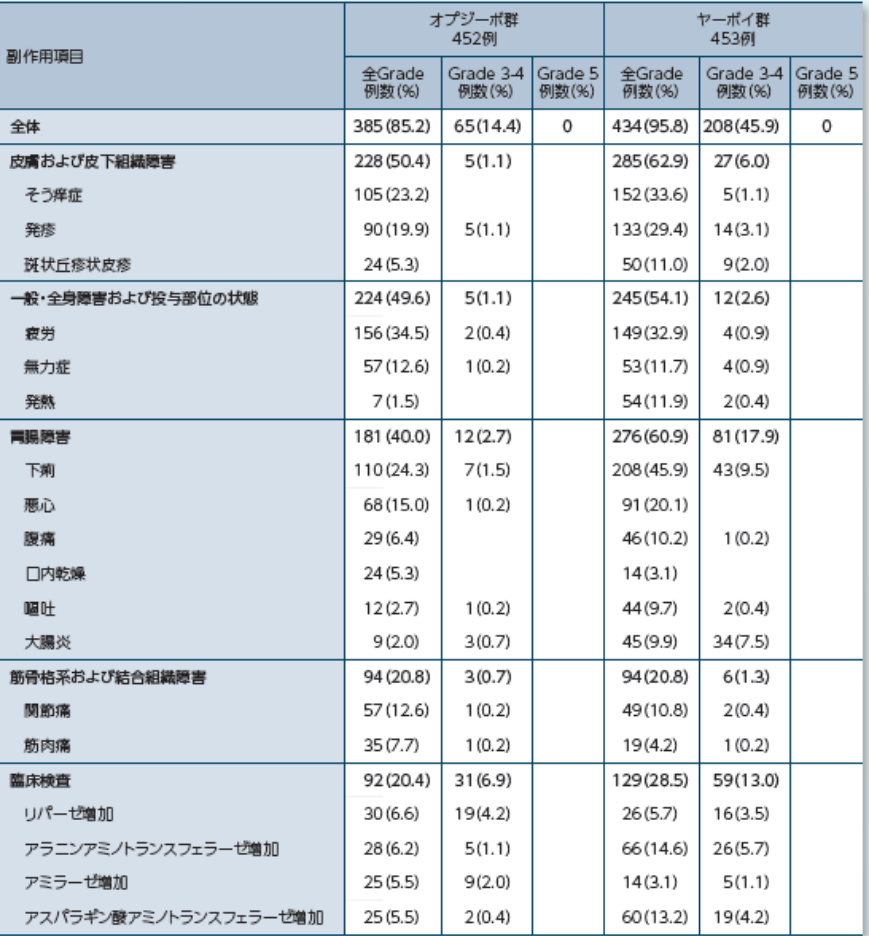
いずれかの群で5%以上に発現した副作用一覧
医師から報告された有害事象名はMedDRA ver. 20.0Jを用いて読み替え、GradeはNCI-CTCAE ver. 4.0を用いて評価しました。因果関係は「関連あり」、「関連なし」の2段階で判定され、「関連あり」と判定された場合に副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。また、副作用の発現頻度は、治験薬の初回投与から最終投与後30日以内に発現・増悪した副作用を対象に集計しました。
1) 小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-21/CA209238)試験成績(社内資料) 承認時評価資料
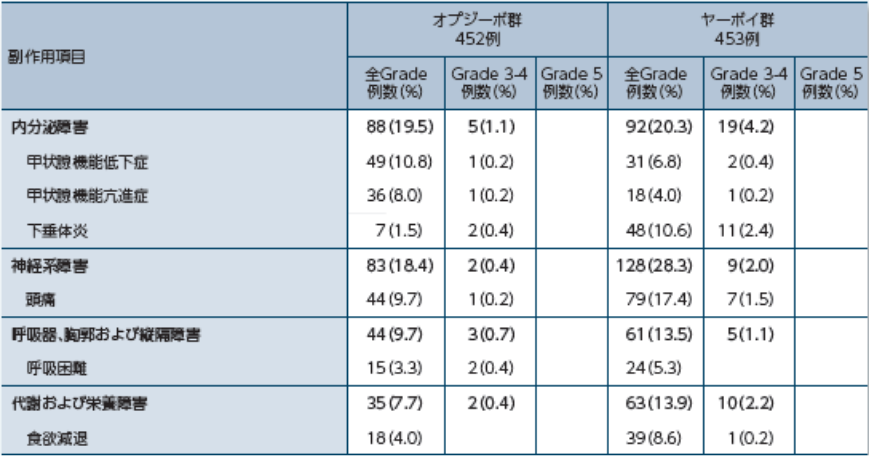
臨床検査値異常変動を含む副作用はオプジーボ群で85.2%(385/452例)、ヤーボイ群で95.8%(434/453例)に認められました。
オプジーボ群で発現率が10%以上の副作用は、疲労34.5%(156例)、下痢24.3%(110例)、そう痒症23.2%(105例)、発疹19.9%(90例)、悪心15.0%(68例)、無力症及び関節痛各12.6%(57例)、並びに甲状腺機能低下症10.8%(49例)でした。一方、ヤーボイ群で発現率が10%以上の副作用は、下痢45.9%(208例)、そう痒症33.6%(152例)、疲労32.9%(149例)、発疹29.4%(133例)、悪心20.1%(91例)、頭痛17.4%(79例)、アラニンアミノトランスフェラーゼ増加14.6%(66例)、アスパラギン酸アミノトランスフェラーゼ増加13.2%(60例)、発熱11.9%(54例)、無力症11.7%(53例)、斑状丘疹状皮疹11.0%(50例)、関節痛10.8%(49例)、下垂体炎10.6%(48例)及び腹痛10.2%(46例)でした。
オプジーボ群で重篤な副作用は5.3%(24例)に認められました。オプジーボ群で発現率が最も高かった重篤な副作用は、下痢及び肺臓炎各0.7%(3例)であり、重篤な副作用の発現率はいずれも3%未満でした。ヤーボイ群で重篤な副作用は31.1%(141例)に認められ、発現率が3%以上の重篤な副作用は、下痢及び大腸炎各7.1%(32例)、下垂体炎3.1%(14例)でした。
オプジーボ群で投与中止に至った副作用は7.7%(35例)に認められました。オプジーボ群で発現率が最も高かった投与中止に至った副作用は、下痢1.5%(7例)であり、投与中止に至った副作用の発現率はいずれも3%未満でした。ヤーボイ群で投与中止に至った副作用は41.7%(189例)に認められました。発現率が3%以上の投与中止に至った副作用は、下痢9.9%(45例)、大腸炎8.2%(37例)、下垂体炎4.2%(19例)及びアラニンアミノトランスフェラーゼ増加3.3%(15例)でした。
治験薬の初回投与から最終投与後30日以内の死亡は、いずれの投与群においても認められませんでした。最終投与後31日以降100日以内に認められた死亡は、オプジーボ群で0.7%(3例:すべて病勢進行による死亡)、ヤーボイ群で0.4%(2例:病勢進行及びその他の理由による死亡)であり、これらにはいずれも治験薬との因果関係は認められませんでした。
最終投与100日後以降に発現した副作用
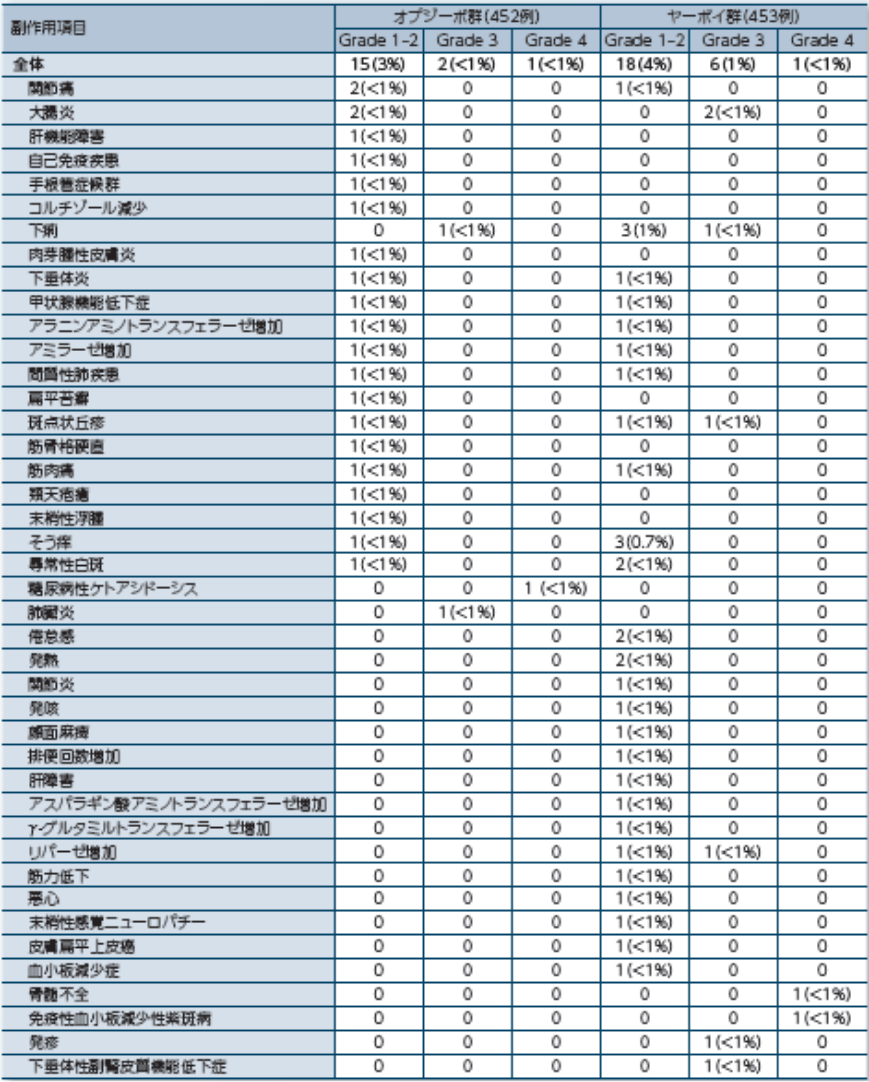
2)Ascierto PA, et al. Lancet Oncol. 2020; 21: 1465-1477.
免疫介在性副作用1)
オプジーボは、その薬理作用から、免疫反応の促進又は過剰による免疫介在性の副作用があらわれることがあります。 観察を十分に行い、異常が認められた場合には、専門医と連携して対処することが重要です。また、早期発見、早期対処が重要ですので、これらの症状が発現した場合はすぐに医療機関にご連絡いただくよう、患者さんにご説明ください。
免疫調節療法を要した免疫介在性副作用
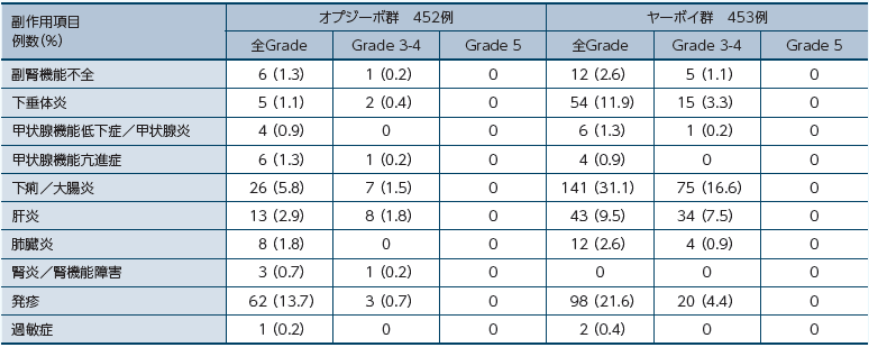
医師から報告された有害事象名はMedDRA ver. 20.0Jを用いて読み替え、GradeはNCI-CTCAE ver. 4.0を用いて評価しました。 因果関係は「関連あり」、「関連なし」の2段階で判定され、「関連あり」と判定された場合に副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。また、副作用の発現頻度は、治験薬の初回投与から最終投与後100日以内に発現・増悪した副作用を対象に集計しました。
内分泌障害の免疫介在性副作用
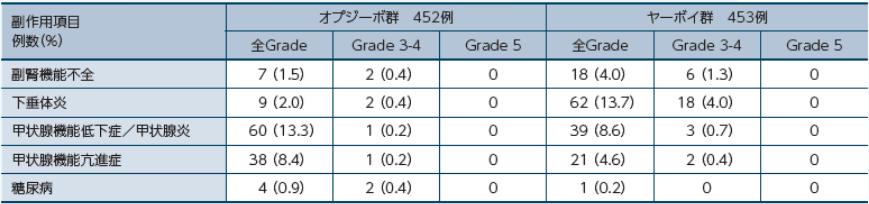
医師から報告された有害事象名はMedDRA ver. 20.0Jを用いて読み替え、GradeはNCI-CTCAE ver. 4.0を用いて評価しました。 因果関係は「関連あり」、「関連なし」の2段階で判定され、「関連あり」と判定された場合に副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。また、副作用の発現頻度は、治験薬の初回投与から最終投与後100日以内に発現・増悪した副作用を対象に集計しました。
1) 小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-21/CA209238)試験成績(社内資料) 承認時評価資料
その他
〔後治療の内訳〕
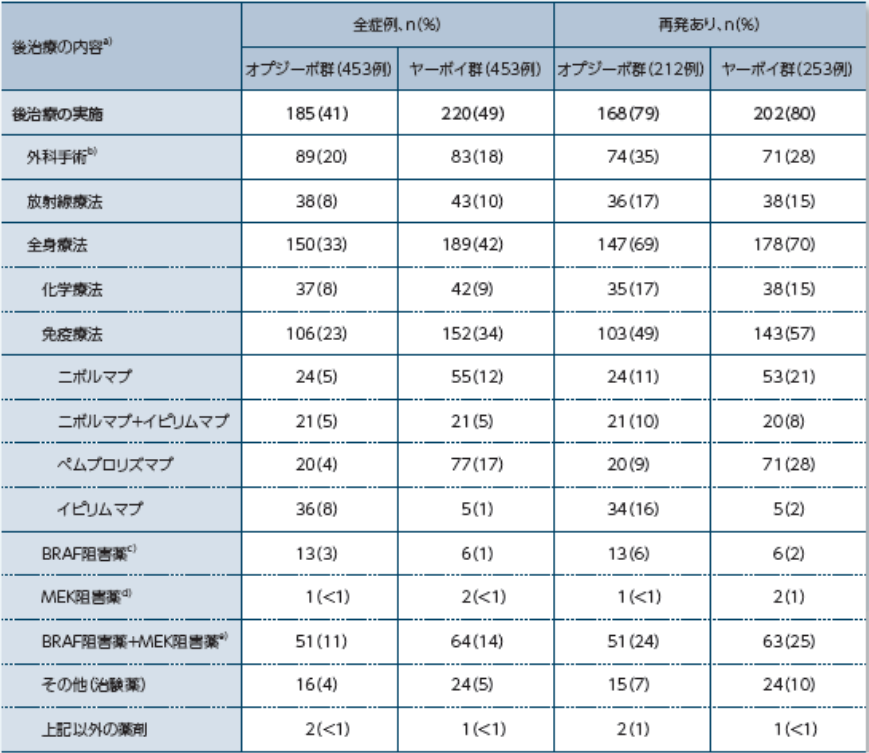
a)2つ以上の後治療を実施した、あるいはそれぞれの治療で2つ以上の薬剤を使用した症例が含まれる可能性がある b)診断・生検を目的とする腫瘍切除を含む c)ダブラフェニブまたはベムラフェニブ d)Cobimetinib(本邦未承認)またはトラメチニブ e)ダブラフェニブ+トラメチニブ かつ/または Cobimetinib(本邦未承認)+ベムラフェニブ 2)Ascierto PA, et al. Lancet Oncol. 2020; 21: 1465-1477. Suppleme ntary Appendix
ヤーボイ
4. 効能又は効果(一部抜粋)
根治切除不能な悪性黒色腫
6. 用法及び用量(一部抜粋)
〈根治切除不能な悪性黒色腫〉
通常、成人にはイピリムマブ(遺伝子組換え)として1回3mg/kg(体重)を3週間間隔で4回点滴静注する。な お、他の抗悪性腫瘍剤と併用する場合は、ニボルマブ(遺伝子組換え)と併用すること。
オプジーボ
6.用法及び用量(一部抜粋)
〈悪性黒色腫〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。ただし、悪性黒色腫における術後補助療法の場合は、投与期間は12ヵ月間までとする。
根治切除不能な悪性黒色腫に対してイピリムマブ(遺伝子組換え)と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回80mgを3週間間隔で4回点滴静注する。その後、ニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
7.用法及び用量に関連する注意
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈悪性黒色腫〉
7.2 根治切除不能な悪性黒色腫に対して、イピリムマブ(遺伝子組換え)と併用する場合は、臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、併用の必要性について慎重に判断すること。また、イピリムマブ(遺伝子組換え)の上乗せによる延命効果は、PD-L1を発現した腫瘍細胞が占める割合(PD-L1発現率)により異なる傾向が示唆されている。イピリムマブ(遺伝子組換え)との併用投与に際してPD-L1発現率の測定結果が得られ、PD-L1発現率が高いことが確認された患者においては、本剤単独投与の実施についても十分検討した上で、慎重に判断すること。[17.1.6参照]

















