CheckMate 743試験(国際第Ⅲ相試験)概要
CheckMate 743試験(国際第Ⅲ相試験)概
要
一次治療におけるオプジーボ+ヤーボイ併用療法の化学療法に対する優越性が検証されました
試験概要
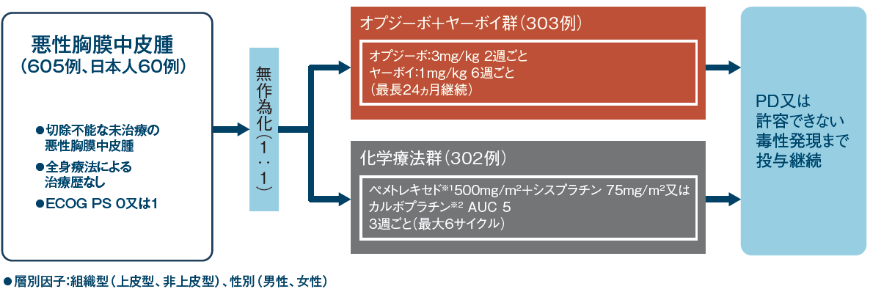
試験デザイン:国際共同非盲検無作為化第Ⅲ相試験[優越性試験]
*1:
*2:
【目的】
化学療法未治療の切除不能な悪性胸膜中皮腫を対象として、オプジーボとヤーボイの併用療法のペメトレキセドとシスプラチン又はカルボプラチンの併用療法に対する優越性を検証するとともに、安全性も検討する
評価項目
主要評価項目:全生存期間(OS)
副次的評価項目:無増悪生存期間(PFS) [m-RECIST又はRECISTガイドライン1.1版に基づくBICR(盲検下での独立中央判定)判定]、奏効率(
ORR[)m-RECIST又はRECISTガイドライン1.1版に基づくBICR判定]、最良総合効果(BOR)、奏効期間(DOR)、奏効に至るまでの期間(TTR)、病勢制御率(DCR)、PD-L1発現率別のOS、
探索的評価項目:EQ-5D-3L UI、EQ-5D-3L VAS、及びLCSS-Meso
安全性:有害事象、臨床検査等
【解析計画】
主要評価項目:Kaplan-Meier法を用いてOS中央値及びその両側95%信頼区間(Brookmeyer-Crowley法)、並びに6、12、18、24、36、48ヵ月及び5年時点のOS率及びそれらの両側95%信頼区間(Greenwood式)を算出した。群間比較には、IRTに基づく組織型及び性別を層別因子とする層別両側log-rank検定を用いた。またランダム化した群を共変量とした層別Cox比例ハザードモデルによりHRとその両側100×(1−調整後のα)%信頼区間を推定した。試験全体の第一種の過誤確率を0.05(両側)とした。中間解析時及び最終解析時の棄却限界値はLan-DeMets法に基づくO'Brien-Fleming型のα消費関数にて調整した。中間解析時点での調整後の有意水準は0.0345であった。
副次的評価項目:PFSの解析はKaplan-Meier法を用いてPFS中央値及びその両側95%信頼区間(Brookmeyer-Crowley法)、並びに6、12、18、24、36、48ヵ月及び5年時点のPFS率及びそれらの両側95%信頼区間(Greenwood式)を算出した。
m-RECIST又はRECISTガイドライン1.1版に基づく盲検下独立中央判定でBORがCR又はPRと判定された場合を奏効と定義した。ORR(BICR)及びその正確な95%信頼区間はClopper-Pearson法により算出した。m-RECIST又はRECISTガイドライン1.1版に基づく盲検下独立中央判定でBORがCR、PR又はSDと判定された場合をDCRと定義した。DCR及びその正確な95%信頼区間は、Clopper-Pearson法により算出した。各投与群でPR又はCRが認められた被験者におけるDORをKaplan-Meier法を用いて推定し、中央値と両側95%信頼区間を算出した。TTRはランダム化された日から最初に奏効が認められた日までの期間と定義した。PD-L1発現率別にOS、PFS及びORRを評価した。
サブグループ解析:事前に規定された日本人部分集団、組織型別のサブグループ解析を行った。また、事前に規定された部分解析集団(年齢、性別、人種、地域、ECOGPS、組織型、病期、喫煙歴、放射線治療既往、全身性がん治療歴、PD-L1発現率など)に対するOS、PFSのサブグループ解析を行った。
小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(CheckMate 743)試験成績(社内資料)承認時評価資料
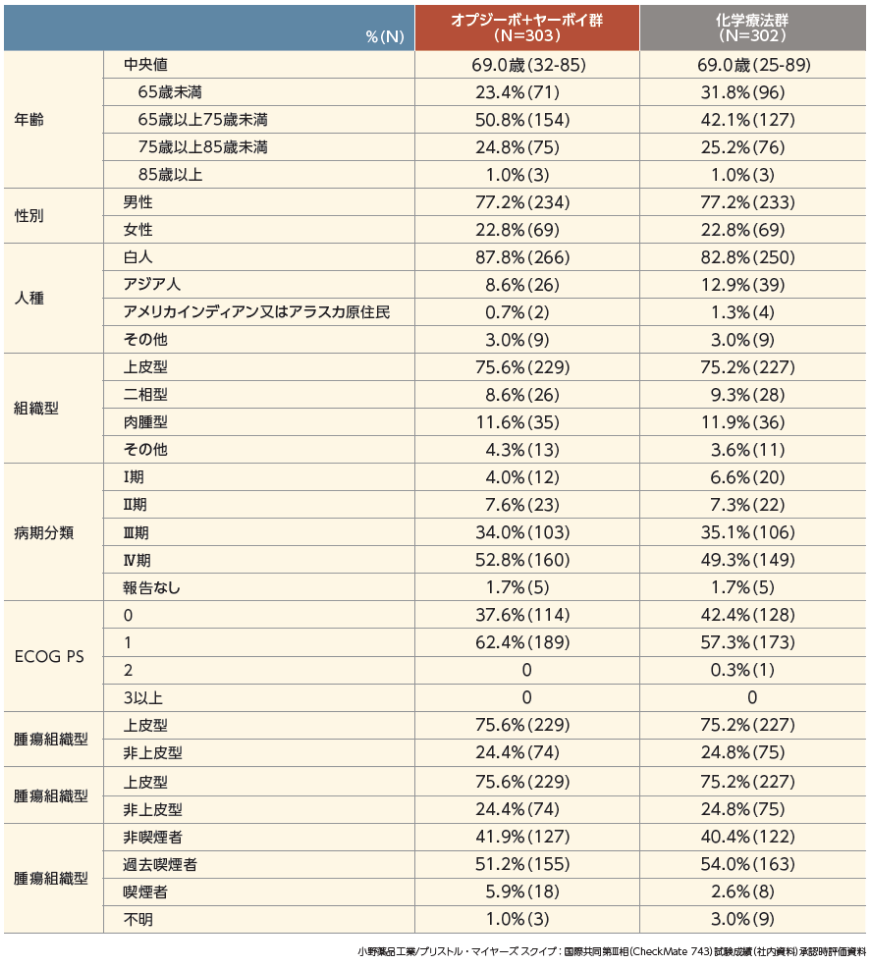
患者背景
有効性
OS[主要評価項目]
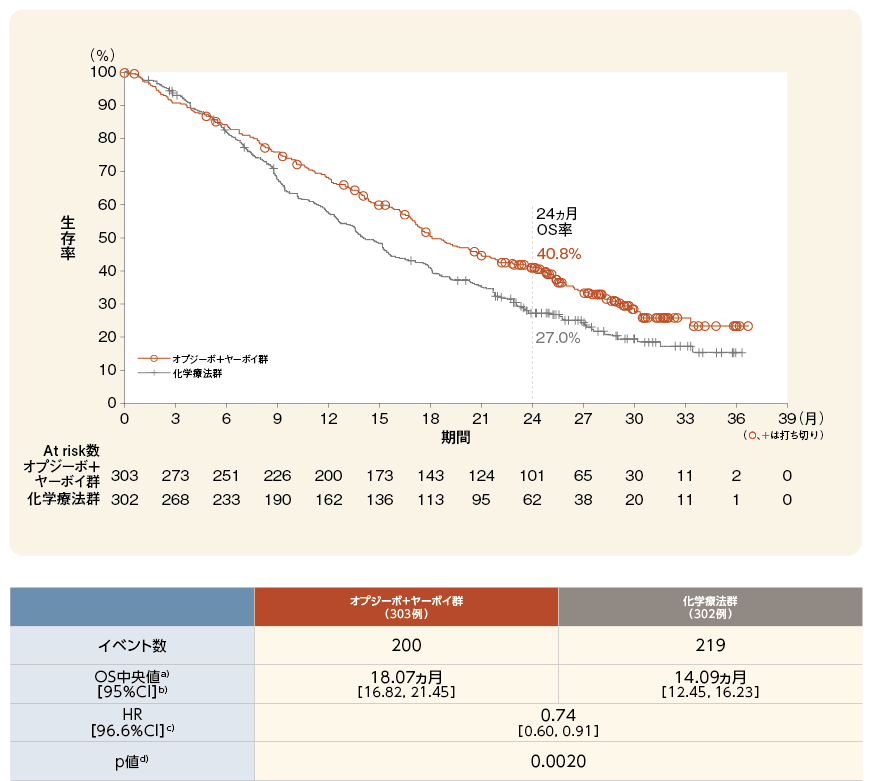
オプジーボ+ヤーボイ群は化学療法群に対してOSを有意に延長しましたd)、*
2 年OS率はオプジーボ+ヤーボイ群で40.8%、化学療法群で27.0%でした
- *検証的解析結果
- a)Kaplan-Meier法
- b)Brookmeyer-Crowley法
- c)層別Cox比例ハザードモデル(共変量:投与群)
- d)層別log-rank検定、両側:有意水準0.0345
- 層別因子:組織型(上皮型、非上皮型)、性別(男性、女性)
PFS[副次的評価項目]
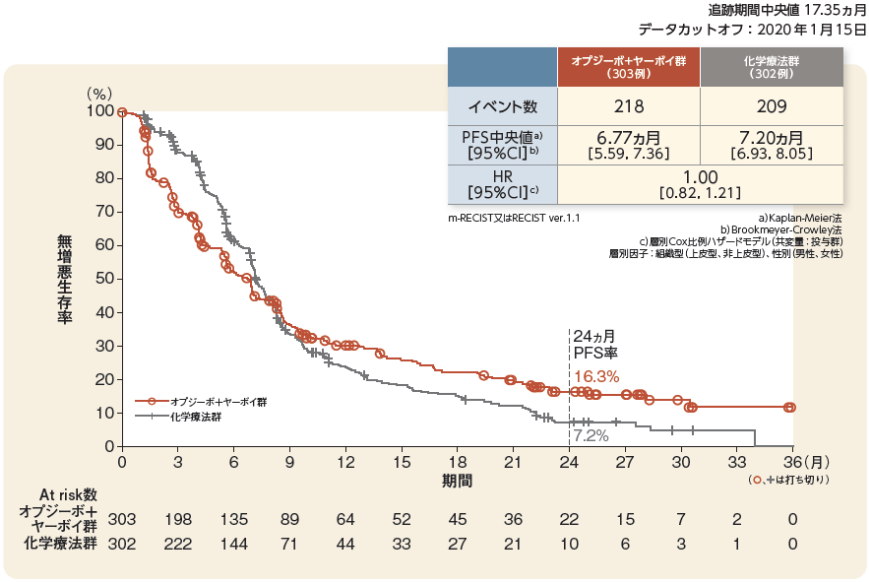
2 年PFS率はオプジーボ+ヤーボイ群で16.3%、化学療法群で7.2%でした
ORR[副次的評価項目]
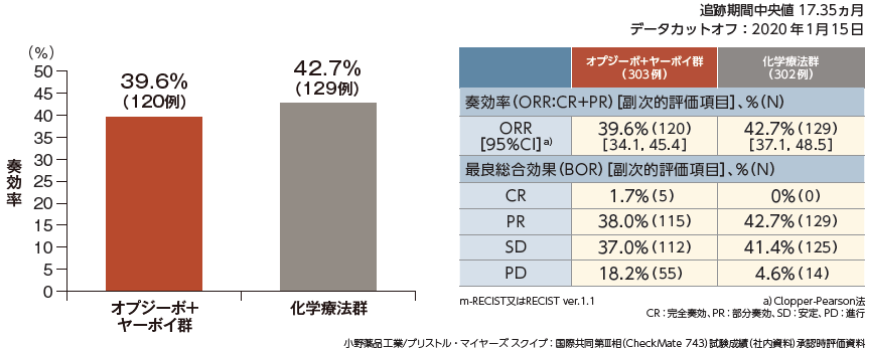
ORR はオプジーボ+ヤーボイ群で39.6%、化学療法群で42.7%でした
安全性
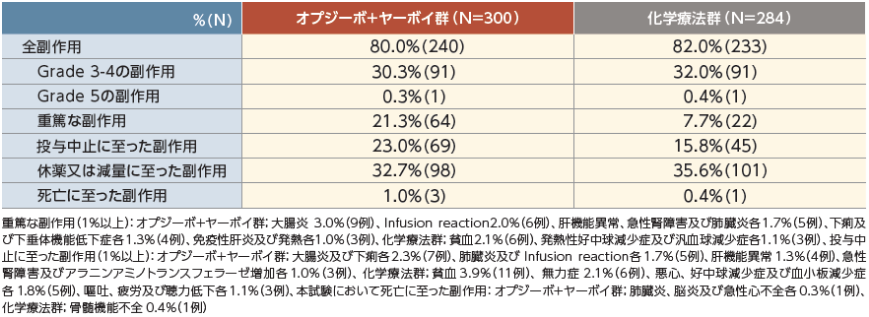
副作用発現率はオプジーボ+ヤーボイ群で80.0%(240/300例)、化学療法群で82.0%(233/284 例)、Grade 3-4が30.3%(91/300 例)、32.0%(91/284 例)でした
小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(CheckMate 743)試験成績(社内資料)承認時評価資料
留意すべき副作用
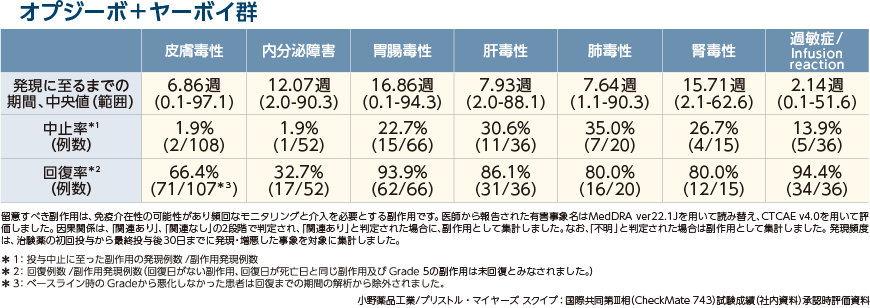
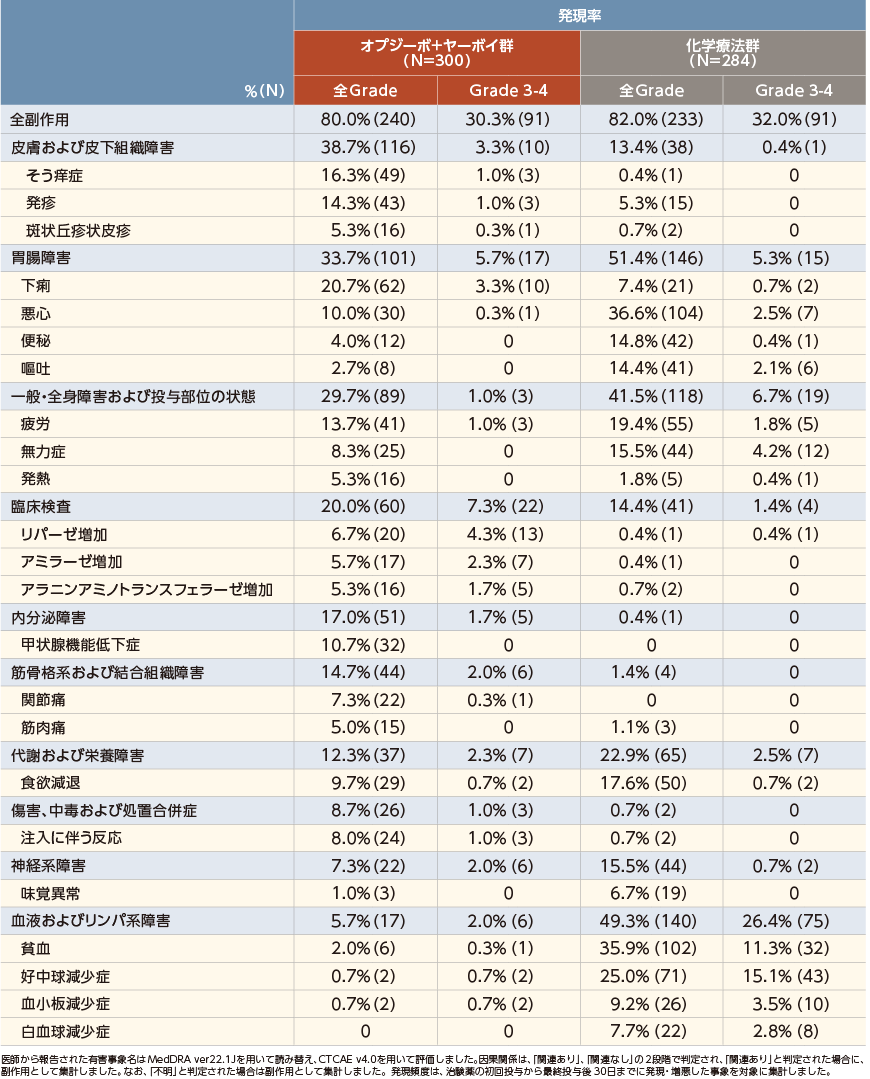
いずれかの群で5%以上に発現した副作用
オプジーボ+ヤーボイ群における留意すべき副作用発現率は、皮膚毒性36.0%、内分泌障害17.3%、胃腸毒性22.0%、肝毒性12.0%、肺毒性6.7%、腎毒性5.0%でした
小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(CheckMate 743)試験成績(社内資料)承認時評価資料
小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(CheckMate 743)試験成績(社内資料)承認時評価資料
その他
OS:上皮型[主要評価項目・サブグループ解析]
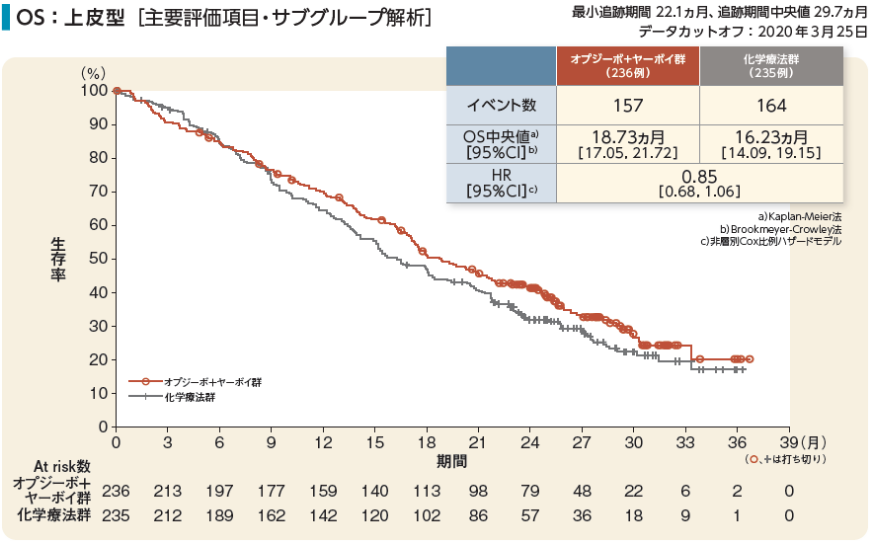
小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(CheckMate 743)試験成績(社内資料)承認時評価資料
OS:非上皮型[主要評価項目・サブグループ解析]
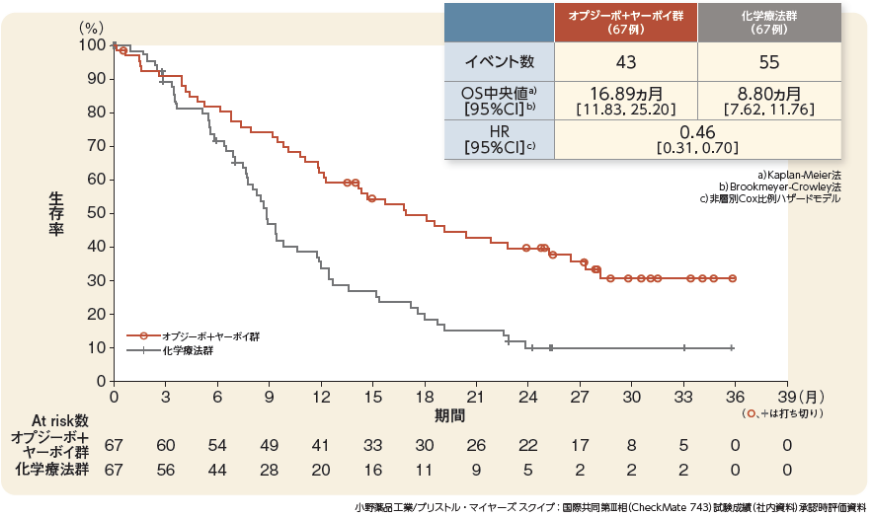
4. 効能又は効果(一部抜粋)
切除不能な進行・再発の悪性胸膜中皮腫
6. 用法及び用量(一部抜粋)
〈切除不能な進行・再発の悪性胸膜中皮腫〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
イピリムマブ(遺伝子組換え)と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。

















