CheckMate 227 試験
(国際共同第Ⅲ相試験)概要
CheckMate 227試験:国際共同第Ⅲ相(ONO-4538-27/CA209227)試験
試験概要
試験デザイン:国際共同非盲検無作為化比較第Ⅲ相試験1)2)
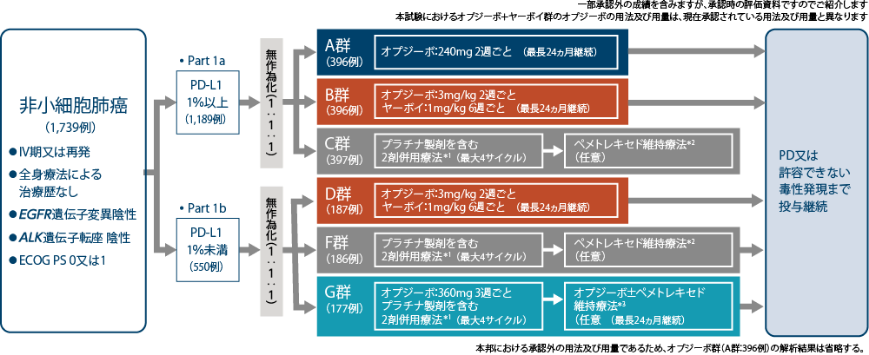
層別因子:組織型(扁平上皮癌、非扁平上皮癌)
-
扁平上皮癌・ゲムシタビン(1,000mg/m2又は1,250mg/m2、day 1及びday 8)*4+シスプラチン(75mg/m2、day 1)又は・ゲムシタビン(1,000mg/m2、day 1及びday 8)*4+カルボプラチン(AUC 5、day 1)*5、又は各国の添付文書に準じる
非扁平上皮癌 ・ペメトレキセド(500mg/m2、day 1)+シスプラチン(75mg/m2、day 1)又は・ペメトレキセド(500mg/m2、day 1)+カルボプラチン(AUC 5又は6、day 1)*5、又は各国の添付文書に準じる -
ペメトレキセド(500mg/m2)3週ごと
-
オプジーボ(360mg、day 1)±ペメトレキセド(500mg/m2、day 1)3週ごと
-
本邦におけるゲムシタビンの用法及び用量(一部抜粋)は、「非小細胞肺癌の場合:通常、成人にはゲムシタビンとして1回1,000mg/m2を30分かけて点滴静注し、週1回投与を3週連続し、4週目は休薬する。これを1コースとして投与を繰り返す。シスプラチンと併用する場合は、ゲムシタビンとして1回1,250mg/m2を30分かけて点滴静注し、週1回投与を2週連続し、3週目は休薬を1コースとすることもできる。なお、患者の状態により適宜減量する。」である。
-
本邦におけるカルボプラチンの用法及び用量(一部抜粋)は、「頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌の場合:通常、成人にはカルボプラチンとして、1日1回300~400mg/m2( 体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、年齢、疾患、症状により適宜増減する。」である。
評価項目
主要評価項目:全生存期間(OS)[Part 1aのPD-L1≧1%の症例を対象としたオプジーボ+ヤーボイ群(B群)と化学療法群(C群)の比較]
副次的評価項目:OS[Part 1bのPD-L1<1%の症例を対象としたオプジーボ+化学療法群(G群)と化学療法群(F群)の比較]、無増悪生存期間(PFS)[RECISTガイドライン1.1版に基づくBICR判定(盲検下での独立中央判定)、主要定義][Part 1bのPD-L1<1%の症例を対象としたオプジーボ+化学療法群(G群)と化学療法群(F群)の比較]
探索的評価項目:PFS[RECISTガイドライン1.1版に基づくBICR判定、主要定義][Part 1aのPD-L1≧1%の症例を対象としたオプジーボ+ヤーボイ群(B群)と化学療法群(C群)の比較]、[Part 1a及びPart 1b]奏効率(ORR)[RECISTガイドライン1.1版に基づくBICR判定]、奏効期間(DOR)、奏効に至るまでの期間(TTR)
安全性:有害事象、免疫介在性有害事象の発現率及び発現時期、臨床検査、免疫原性等
【目的】
化学療法未治療のⅣ期又は再発の非小細胞肺癌を対象として、オプジーボとヤーボイ併用療法の有効性と安全性を、プラチナ製剤を含む2剤化学療法と比較検討する。また、オプジーボとプラチナ製剤を含む2剤化学療法との併用療法の有効性と安全性を、プラチナ製剤を含む2剤化学療法と比較検討する。
【試験デザイン】
国際共同非盲検無作為化比較第Ⅲ相試験
【対象】
化学療法未治療のⅣ期又は再発の非小細胞肺癌患者1,739例(日本人206例)
【解析計画】
主要評価項目:[Part 1aにおけるオプジーボ+ヤーボイ群(B群)と化学療法群(C群)の全生存期間(OS)の比較]OSイベントが388件発生した時点で中間解析を計画した。中間解析及び最終解析の有意水準は、解析時点の実際のOSイベント数に基づいて、O’Brien-Fleming型のLan-DeMets法によるα消費関数を用いて決定した。最終解析における有意水準を0.0228とし、組織型を層別因子とした両側層別log-rank検定を用いて2群間を比較した。投与群間のハザード比とその両側97.72%信頼区間(CI)は、投与群を共変量とし、組織型を層別因子としたCox比例ハザードモデルを用いて推定した。また、Kaplan-Meier曲線を示し、Kaplan-Meier法を用いてOS中央値及びその95%信頼区間、並びに6、12、18、24、36及び48ヵ月時のOS率及びそれらの95%信頼区間を投与群別に推定した。
副次的評価項目:【階層的検定】Part 1(Part 1a及びPart 1b)全体のα( 第1種過誤確率)を両側0.05とし、2つの主要有効性評価項目の間でαを分割した(規定の中間解析の奏効率(ORR)にα=0.0001、PD-L1≧1%の被験者におけるOSにα=0.0249、TMB≧10mut/Mbの被験者における無増悪生存期間(PFS)にα=0.025)。副次的評価項目の解析は、第1種過誤確率を保持するために階層的検定手順を用いた。主要評価項目の解析であるPD-L1≧1%の被験者におけるオプジーボ+ヤーボイ群(B群)と化学療法群(C群)のOSの比較において、オプジーボ+ヤーボイ群(B群)の化学療法群(C群)に対する優越性が認められた場合、PD-L1階層的検定として以下の副次的評価項目の検定を順次実施することとした。
1. PD-L1<1%の被験者を対象とした、オプジーボ+化学療法群(G群)と化学療法群(F群)のPFSの比較
2. PD-L1<1%の被験者を対象とした、オプジーボ+化学療法群(G群)と化学療法群(F群)のOSの比較
3. PD-L1≧50%の被験者を対象とした、オプジーボ群(A群)と化学療法群(C群)のOSの比較
Part 1bにおけるオプジーボ+化学療法群(G群)と化学療法群(F群)のOS及びPFSの比較について、主要評価項目と同様の解析を実施した。
探索的評価項目: Part 1aにおけるBICRによるPFSのHR[オプジーボ+ヤーボイ群(B群)vs 化学療法群(C群)]及びその両側97.5%信頼区間は、投与群を単一の共変量とし、組織型を層別因子としたCox比例ハザードモデルを用いて推定した。PFS曲線、PFSの中央値及びその95%信頼区間、並びに6、12、18、24、36及び48ヵ月時点のPFS率及びその95%信頼区間はKaplan-Meier法を用いて推定した。
Part 1において、BICRによるORRは投与群ごとに推定し、その正確な両側95%信頼区間をClopper-Pearson法を用いて算出した。2投与群間のORRにおける重みを考慮しない差とその両側95%信頼区間をNewcombe法を用いて算出した。BICRによる最良総合効果(BOR)は各投与群について効果の分類ごとに要約した。部分奏効(PR)又は完全奏効(CR)が認められた被験者における奏効に至るまでの期間(TTR)の要約統計量を各投与群について示した。各投与群でPR又はCRが認められた被験者における奏効期間(DOR)をKaplan-Meier法を用いて推定し、中央値と両側95%信頼区間を算出した。
サブグループ解析:Part 1a及びPart 1bにおいて、事前に規定された日本人部分集団を対象としたサブグループ解析を行った。また、Part 1a(B群 vs C群)及びPart 1b(D群 vs F群)において、事前に規定された部分解析集団(年齢、性別、人種、地域、ECOG PS、喫煙歴、組織型、治験責任医師選択による化学療法、TMB、PD-L1発現率、肝転移、骨転移、中枢神経系転移など)に対するOS、PFS、ORRのサブグループ解析を行った。
追加解析:記述的解析として、最終解析時にPart 1bのオプジーボ+ヤーボイ群(D群)と化学療法群(F群)の有効性評価項目(OS、PFS、ORR、BOR、DOR、TTR)の比較を行った。解析手法はOS、PFSについてはPart 1aのPFSに準じ、ORR、BOR、DOR、TTRについてはPart 1aに準じた。また、日本人部分集団を対象としてオプジーボ+ヤーボイ群(D群)と化学療法群(F群)を比較するサブグループ解析を行った。さらに、Part 1bのG群 vs F群に準じてD群 vs F群に関しても部分解析集団に対するOSのサブグループ解析を行った。追加解析は治験実施計画書・統計解析計画書で計画した解析ではないものの、承認申請資料として提出し、その承認審査過程で評価を受けた。
安全性:免疫介在性有害事象は発現率及び発現時期を解析した。
1)小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-27/CA209227)試験成績(社内資料) 承認時評価資料
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
患者背景
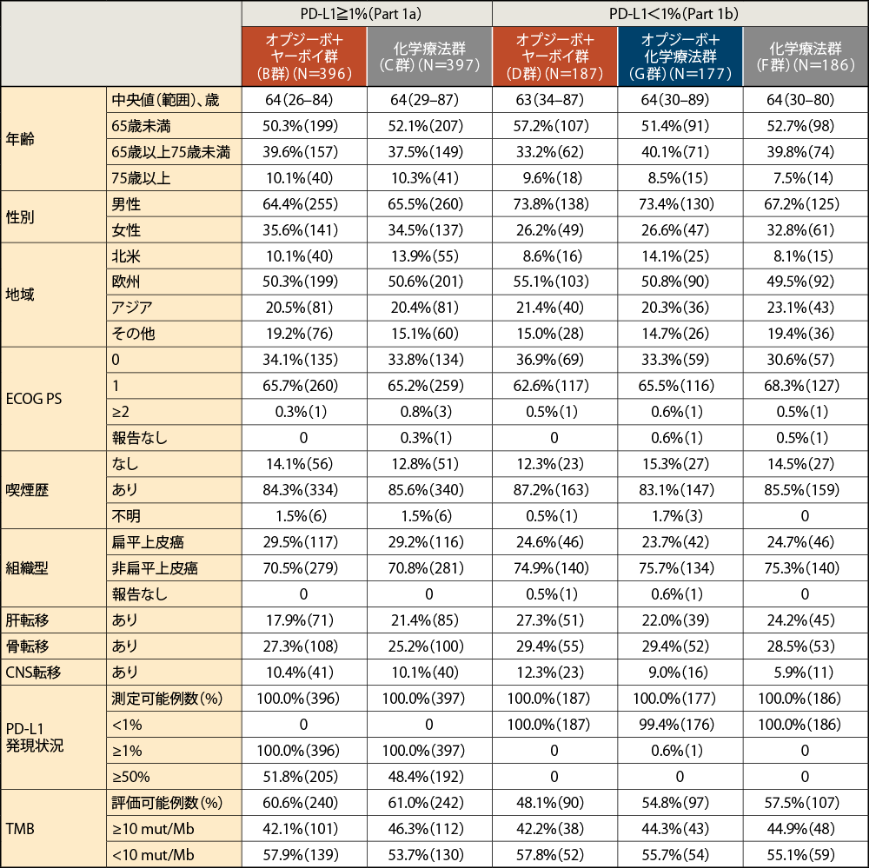
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
有効性
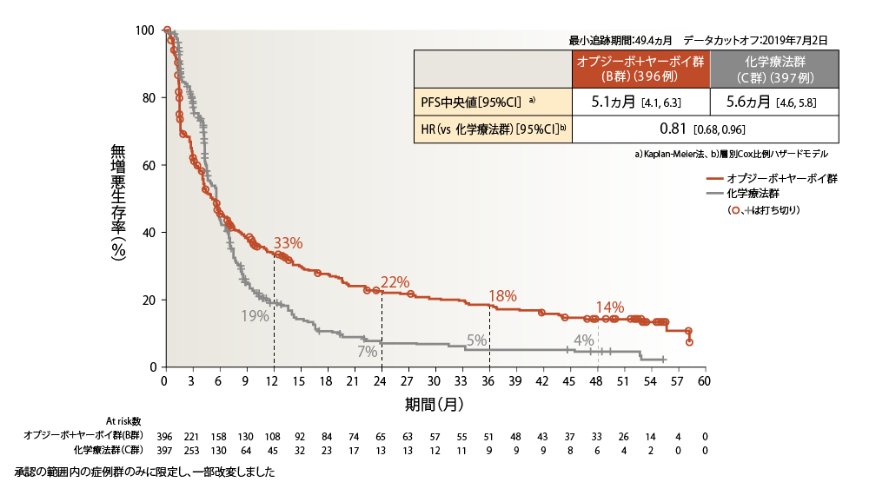
●OS(PD-L1≧1%)[主要評価項目]
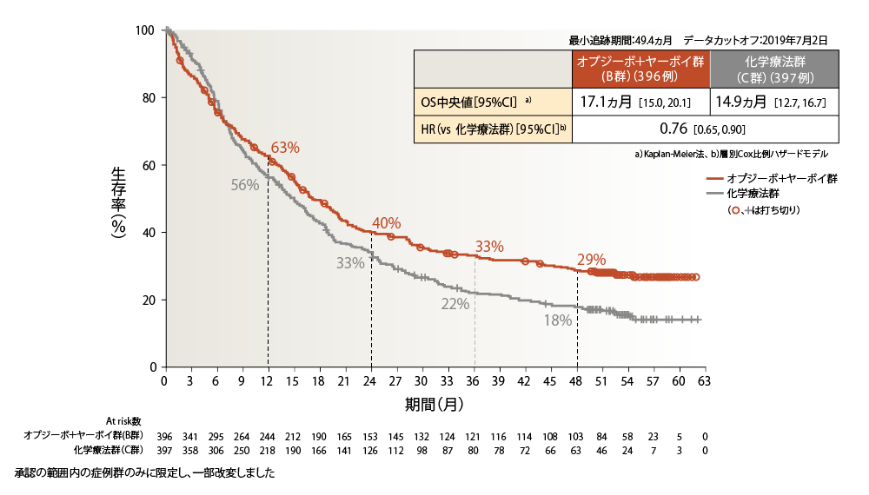
PD-L1≧1%の4年OS率は、オプジーボ+ヤーボイ群29%、化学療法群18%でした
PD-L1≧1%のオプジーボ+ヤーボイ群の化学療法群に対するOSのHRは0.76でした2)
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
●OS(PD-L1<1%)[副次的評価項目]
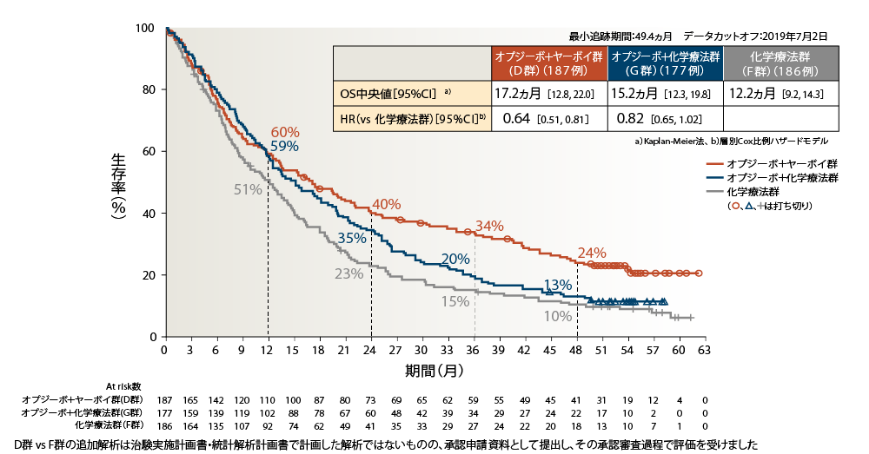
PD-L1<1%の4年OS率は、オプジーボ+ヤーボイ群24%、オプジーボ+化学療法群13%、化学療法群10%でした
PD-L1<1%のオプジーボ+ヤーボイ群の化学療法群に対するOSのHRは0.64、オプジーボ+化学法群の化学療法群に対するOSのHRは0.82でした2)
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
●PFS(PD-L1≧1%)[探索的評価項目]
PD-L1≧1%の4年PFS率は、オプジーボ+ヤーボイ群14%、化学療法群4%でした
PD-L1≧1%のオプジーボ+ヤーボイ群の化学療法群に対するPFSのHRは0.81でした2)
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
●PFS(PD-L1<1%)[副次的評価項目]
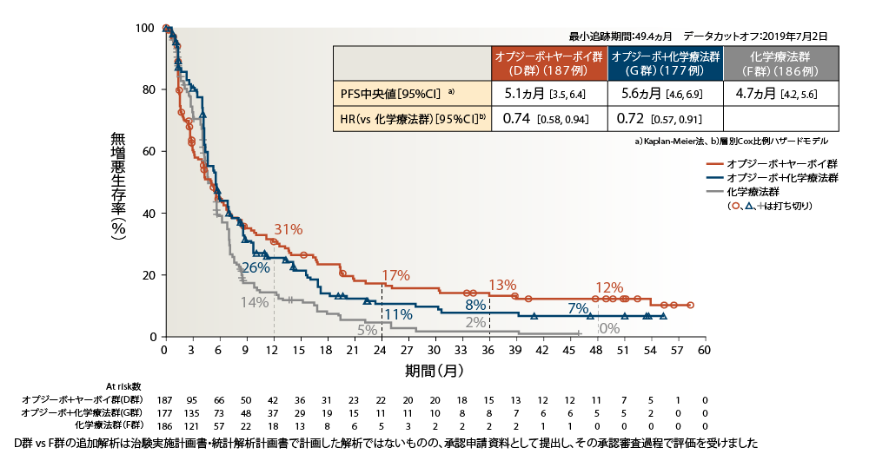
PD-L1<1%の4年PFS率は、オプジーボ+ヤーボイ群12%、オプジーボ+化学療法群7%、化学療法群0%でした
PD-L1<1%のオプジーボ+ヤーボイ群の化学療法群に対するPFSのHRは0.74、オプジーボ+化学療法群の化学療法群に対するPFSのHRは0.72でした2)
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
安全性

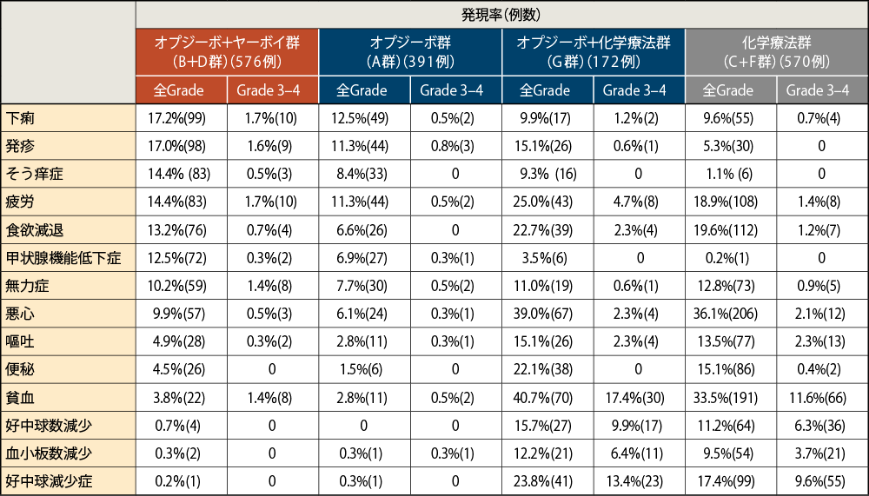
●主な副作用(いずれかの群で10%以上に発現したもの)
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
4年Follow-upにおける主な副作用(10%以上)はオプジーボ+ヤーボイ統合群(B+D群)では下痢17.2%(99例)、発疹17.0%(98例)、そう痒症及び疲労各14.4%(83例)、食欲減退13.2%(76例)、甲状腺機能低下症12.5%(72例)、無力症10.2%(59例)、オプジーボ群(A群)では下痢12.5%(49例)、発疹及び疲労各11.3%(44例)、オプジーボ+化学療法群(G群)では貧血40.7%(70例)、悪心39.0%(67例)、疲労25.0%(43例)、好中球減少症23.8%(41例)、食欲減退22.7%(39例)、便秘22.1%(38例)、好中球数減少15.7%(27例)、発疹及び嘔吐各15.1%(26例)、血小板数減少12.2%(21例)、無力症11.0%(19例)、化学療法統合群(C+F群)では悪心36.1%(206例)、貧血33.5%(191例)、食欲減退19.6%(112例)、疲労18.9%(108例)、好中球減少症17.4%(99例)、便秘15.1%(86例)、嘔吐13.5%(77例)、無力症12.8%(73例)、好中球数減少11.2%(64例)でした2)。
承認時評価資料における重篤な副作用のうち主なもの(1%以上)はオプジーボ+ヤーボイ統合群(B+D群)では肺臓炎4.2%(24例)、下痢及び副腎機能不全各2.1%(12例)、大腸炎1.7%(10例)、下垂体炎及び肝炎各1.4%(8例)、オプジーボ群(A群)では肺臓炎2.6%(10例)、オプジーボ+化学療法群(G群)では貧血4.1%(7例)、血小板減少症2.3%(4例)、肺臓炎及び汎血球減少症各1.7%(3例)、アラニンアミノトランスフェラーゼ増加、疲労及び肺炎各1.2%(2例)、化学療法統合群(C+F群)では貧血2.5%(14例)、発熱性好中球減少症1.9%(11例)、嘔吐1.2%(7例)、悪心及び血小板減少症各1.1%(6例)でした1)。
承認時評価資料における投与中止に至った副作用のうち主なもの(1%以上)はオプジーボ+ヤーボイ統合群(B+D群)では肺臓炎3.6%(21例)、下痢2.1%(12例)、間質性肺疾患及び肝炎各1.0%(6例)、オプジーボ群(A群)では肺臓炎2.3%(9例)、下痢1.0%(4例)、オプジーボ+化学療法群(G群)では大腸炎、肺臓炎、血中クレアチニン増加、腎クレアチニン・クリアランス減少及び食欲減退各1.2%(2例)でした。化学療法統合群(C+F群)で最も発現率が高かった投与中止に至った副作用は疲労及び貧血各0.9%(5例)でした1)。
4年Follow-upにおいて最終投与後30日までに死亡に至った副作用は、オプジーボ+ヤーボイ統合群(B+D群)では肺臓炎4例、ショック、心筋炎、急性尿細管壊死及び心タンポナーデが各1例、オプジーボ群(A群)では肺臓炎及び敗血症を伴う重篤な好中球減少症各1例、オプジーボ+化学療法群(G群)では血液量減少性ショック、肺塞栓症、呼吸不全及び汎血球減少症各1例、化学療法統合群(C+F群)では敗血症2例、好中球減少性敗血症、脳梗塞、間質性肺疾患及び血小板減少症各1例が認められました2)。
化学療法未治療の非小細胞肺癌に対するオプジーボ単独投与の有効性及び安全性は確立していません
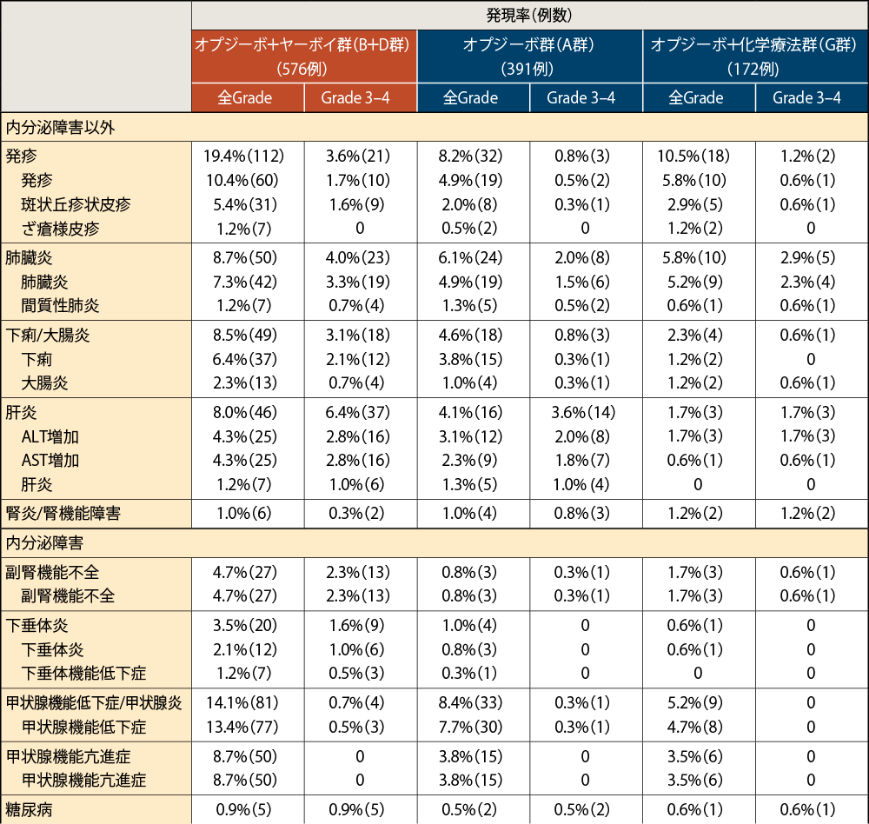
●免疫介在性有害事象の発現率
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
全Gradeの主な免疫介在性有害事象は、オプジーボ+ヤーボイ統合群(B+D群)では発疹19.4%(112例)、甲状腺機能低下症/甲状腺炎14.1%(81例)、オプジーボ群(A群)では甲状腺機能低下症/甲状腺炎8.4%(33例)、発疹8.2%(32例)、オプジーボ+化学療法群(G群)では発疹10.5%(18例)、肺臓炎5.8%(10例)などでした。
Grade 3-4の免疫介在性有害事象は、オプジーボ+ヤーボイ統合群(B+D群)では肝炎6.4%(37例)、肺臓炎4.0%(23例)、オプジーボ群(A群)では肝炎3.6%(14例)、肺臓炎2.0%(8例)、オプジーボ+化学療法群(G群)では肺臓炎2.9%(5例)、肝炎1.7%(3例)などでした2)。
化学療法未治療の非小細胞肺癌に対するオプジーボ単独投与の有効性及び安全性は確立していません
●免疫介在性有害事象の発現時期
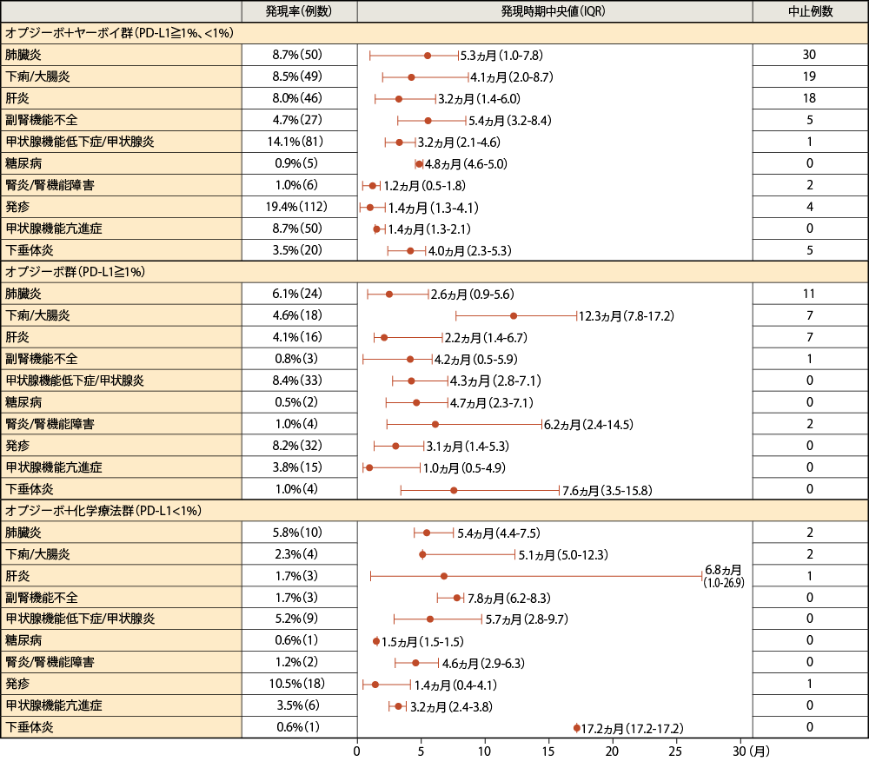
化学療法未治療の非小細胞肺癌に対するオプジーボ単独投与の有効性及び安全性は確立していません
その他
●後治療の概要
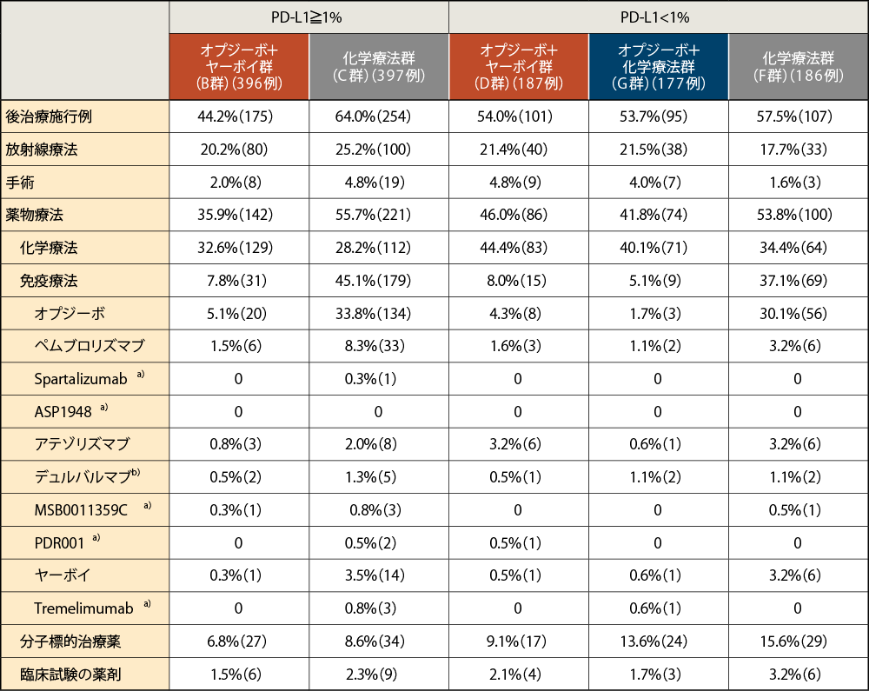
無作為化された全症例のうち、PD-L1≧1%では、オプジーボ+ヤーボイ群の44.2%(175/396例)、化学療法群の64.0%(254/397例)で後治療が施行され、それぞれ化学療法(32.6%)、免疫療法(45.1%)が主に施行されました
PD-L1<1%では、オプジーボ+ヤーボイ群の54.0%(101/187例)、オプジーボ+化学療法群の53.7%(95/177例)、化学療法群の57.5%(107/186例)で後治療が施行され、それぞれ化学療法(44.4%)、化学療法(40.1%)、化学療法と免疫療法(それぞれ34.4%、37.1%)が主に施行されました2)
a)本邦未承認、b)本邦におけるデュルバルマブの効能又は効果は「切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法、進展型小細胞肺癌」である
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
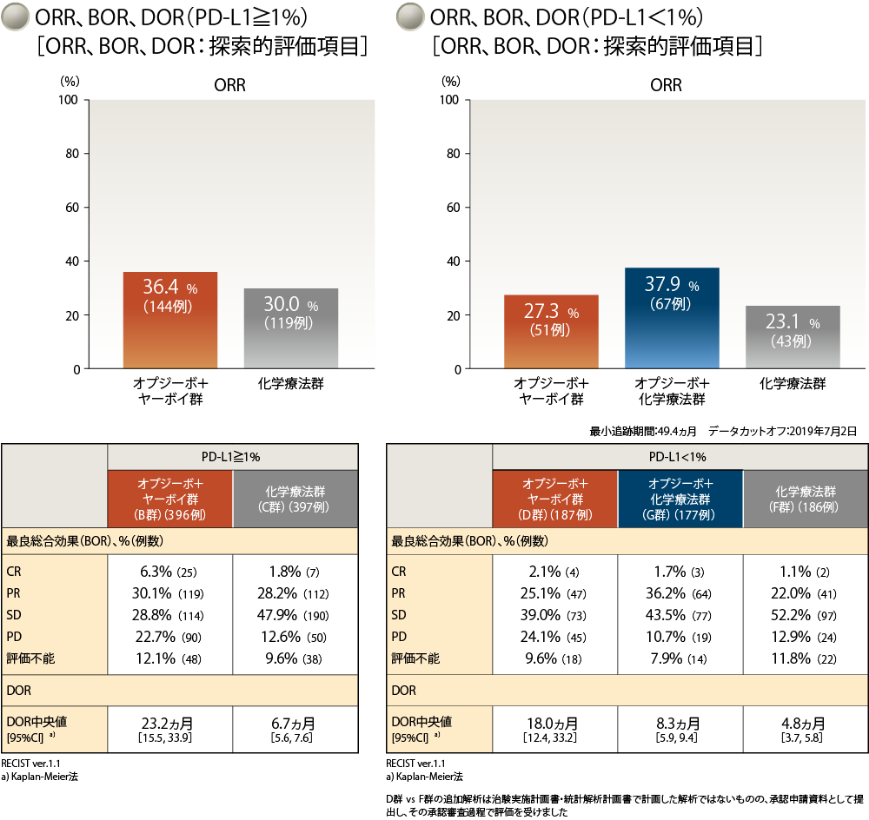
4年Follow-upにおいて、奏効率は、PD-L1≧1%ではオプジーボ+ヤーボイ群36.4%、化学療法群30.0%でした
PD-L1<1%ではオプジーボ+ヤーボイ群27.3%、オプジーボ+化学療法群37.9%、化学療法群23.1%でした2)
2)Paz-Ares LG, et al. J Thorac Oncol. 2021; S1556-0864(21)03207-X.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
6. 用法及び用量(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈切除不能な進行・再発の非小細胞肺癌〉
7.3 化学療法未治療患者に対する本剤単独投与の有効性及び安全性は確立していない。
7.4 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は、「17. 臨床成績」の項の内容を熟知し、臨床試験において検討された患者のPD-L1発現率を考慮した上で選択すること。

















