CheckMate 9LA試験(国際共同第Ⅲ相試験)
概要
CheckMate 9LA試験では、オプジーボ+ヤーボイ+2サイクル化学療法併用療法の化学療法に対する有効性と安全性が検討されました
試験概要
試験デザイン
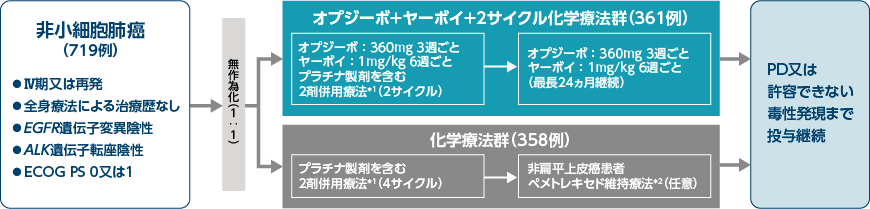
層別因子:PD-L1発現レベル(1%以上、1%未満及び定量不能)、 組織型(扁平上皮癌、非扁平上皮癌)及び性別(男性、女性)
-
扁平上皮癌
・カルボプラチン(AUC 6、day 1)*3+パクリタキセル(200mg/m2、day 1)*4
非扁平上皮癌 ・カルボプラチン(AUC 5又は6、day 1)*3+ペメトレキセド(500mg/m2、day 1)又は・シスプラチン(75mg/m2、day 1)+ペメトレキセド(500mg/m2、day 1) -
ペメトレキセド(500mg/m2)3週ごと
-
本邦におけるカルボプラチンの用法及び用量(一部抜粋)は、「頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌の場合:通常、成人にはカルボプラチンとして、1日1回300~ 400mg/m2 (体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、年齢、疾患、症状により適宜増減する。」である。
-
本邦におけるパクリタキセルの非小細胞肺癌に対する用法及び用量は「通常、成人にはパクリタキセルとして、1日1回210mg/m2(体表面積)を3時間かけて点滴静注し、少なくとも3週間休薬する。これを1クールとして、投与を繰り返す。」である。
評価項目
主要評価項目:全生存期間(OS)
副次的評価項目:無増悪生存期間(PFS)[RECISTガイドライン1.1版に基づくBICR(盲検下での独立中央判定)判定、主要定義]、奏効率(ORR)[RECISTガイドライン1.1版に基づくBICR判定]、ORRをBICR判定による奏効期間(DOR)及び奏効に至るまでの期間(TTR)で特徴付け、標的病変の腫瘍径の最大変化率によってさらに詳しく解析した
安全性:有害事象、臨床検査、免疫原性等
【目的】
化学療法未治療のⅣ期又は再発の非小細胞肺癌を対象として、オプジーボ+ヤーボイ+プラチナ製剤を含む2剤化学療法(2サイクル)の併用療法のプラチナ製剤を含む2剤化学療法に対する有効性・安全性を検討する。
【試験デザイン】
国際共同非盲検無作為化第Ⅲ相試験[優越性試験]
【対象】
化学療法未治療のⅣ期又は再発の非小細胞肺癌患者719例(日本人50例)
オプジーボ+ヤーボイ+2サイクル化学療法群:361例(日本人22例)、化学療法群:358例(日本人28例)
【解析計画】
主要評価項目:全生存期間(OS)の解析は、試験全体の両側第1種過誤確率を0.05とし、組織型、性別及びPD-L1発現レベル(1%以上又は1%未満及び定量不能)
で層別化した両側層別log-rank検定に基づいて実施した。O’Brien-Fleming型の限界値を用いたLan-DeMetsのα消費関数により、中間解析の名目有意水準を決定した(名目有意水準0.0329は実際のOSのイベント数が351件であることに基づいている)。投与群を単一の共変量とする層別Cox比例ハザードモデルを用い、投与群間のOSの層別ハザード比(HR)及びその両側96.71%信頼区間を推定した。また、Kaplan-Meier法を用いて中央値及び95%信頼区間、並びに6、9、12、24ヵ月時のOS率及びそれらの95%信頼区間を推定した。
副次的評価項目:階層検定手順により無増悪生存期間(PFS)(BICR)及び奏効率(ORR)(BICR)の評価を行った。OSの解析で統計学的な有意差が認められた場合に限り、本階層検定を実施することとした。中間解析及び最終解析時の中止限界値は、解析時点における実際のPFS(BICR)イベント数に基づき、O’Brien-Fleming型の限界値を用いたLan-DeMetsのα消費関数により決定することとした。ORR(BICR)の有意水準は、Bonferroni法によって両側α=0.05を等分し、α=0.025に予め規定した。主な副次的評価項目の階層順序は1)PFS(BICR)、2)ORR(BICR)であった。
PFS(BICR)の解析は、層別log-rank検定により投与群間で比較した。層別因子は、組織型、性別及びPD-L1発現レベル(1%以上又は1%未満及び定量不能)であった。データベースロック時点における実際のPFSイベント数は481件であったため、O’Brien-Fleming法による調整α=0.0252を適用した。投与群を単一の共変量とする層別Cox比例ハザードモデルを用い、投与群間のPFSのHR推定値とその97.48
%信頼区間を算出した。また、Kaplan-Meier法を用いて中央値及び95%信頼区間、並びに6、9、12、24ヵ月時のPFS率及びそれらの95%信頼区間を推定した。
ORR(BICR)の推定値及びその両側95%信頼区間、並びに12、24ヵ月時のORRの推定値及びその両側95%信頼区間はClopper-Pearson法により算出した。群間差の推定値とその両側97.5%信頼区間は、層別因子で調整したCochran-Mantel-Haenszel法により算出した。投与群間のORRのオッズ比についても両側97.5%信頼区間を算出した。記述目的のために、奏効の群間差の両側95%信頼区間及び投与群間の奏効のオッズ比の両側95%信頼区間も示した。治験責任(分担)医師によるORR評価に対しても同様の解析を実施した。BICRによる最良総合効果(BOR)の各分類[完全奏効(CR)、部分奏効(PR)、安定(SD)、進行(PD)又は評価不能]における被験者数及び被験者の割合を投与群別に示した。PR又はCRを達成した被験者 について、Kaplan-Meier法を用いてDOR(中央値及び両側95%信頼区間)及びTTRを推定した。
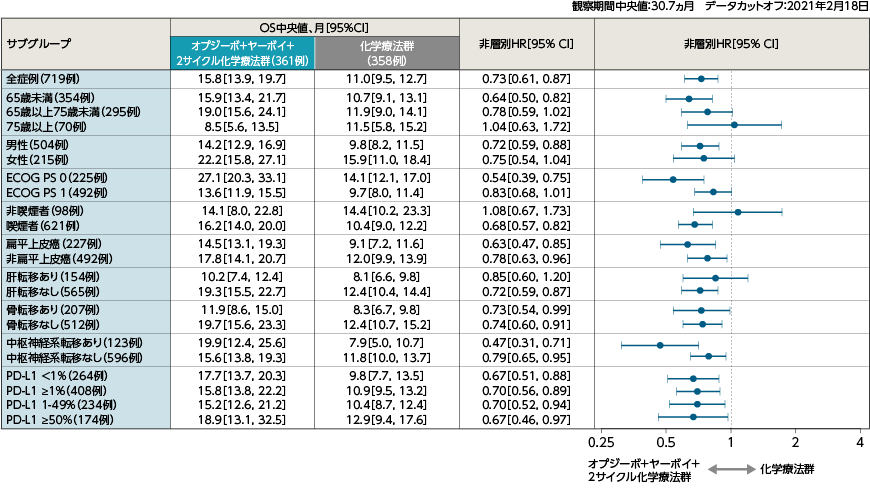
サブグループ解析:事前に規定された日本人部分集団、組織型別(扁平上皮癌、非扁平上皮癌)、PD-L1発現率別(<1%、≧1%、1-49%、≧50%)のサブグループ解析を行った。また、事前に規定された部分解析集団(年齢、性別、人種、地域、ECOG
PS、喫煙歴、組織型、治験責任医師選択による化学療法、PD-L1発現率、PD-L1 サブグループ別、病期、肝転移、骨転移、中枢神経系転移など)に対するOS、PFS、ORRのサブグループ解析を行った。
安全性:免疫介在性有害事象は発現率及び発現時期とともに、回復率及び回復時期を解析した。
小野薬品工業 / ブリストル・ マイヤーズ スクイブ:国際共同第Ⅲ相(CheckMate 9LA)試験成績(社内資料)承認時評価資料
Paz-Ares L, et al. Lancet Oncol. 2021; 22: 198-211.
Reck M, et al. ESMO Open. 2021: 6; 100273.
[利益相反] 本試験は、Bristol-Myers Squibb 及び⼩野薬品⼯業の⽀援を受けて実施された。
有効性
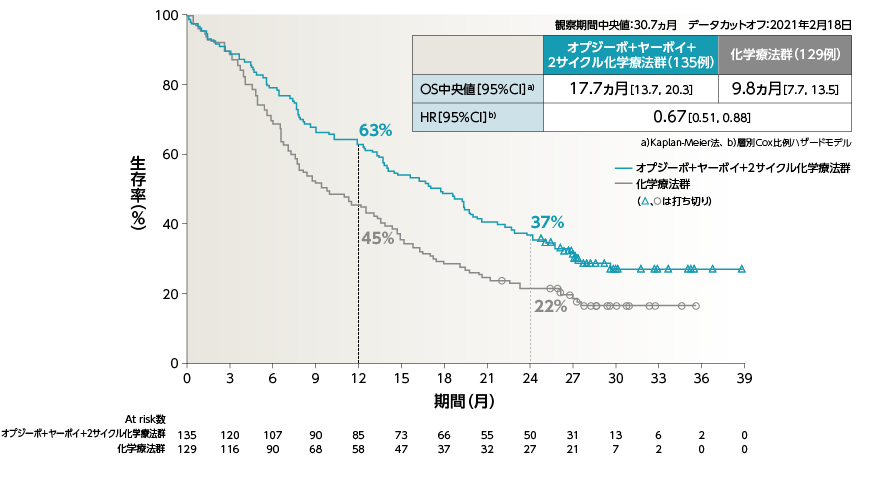
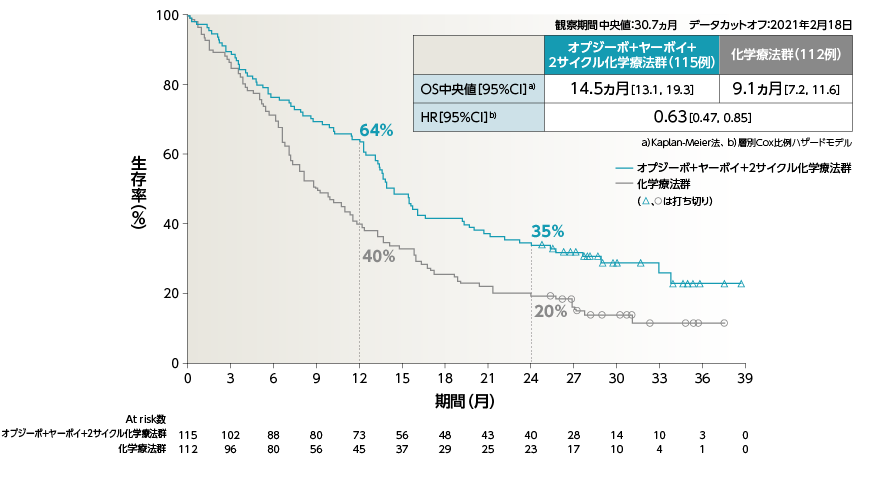
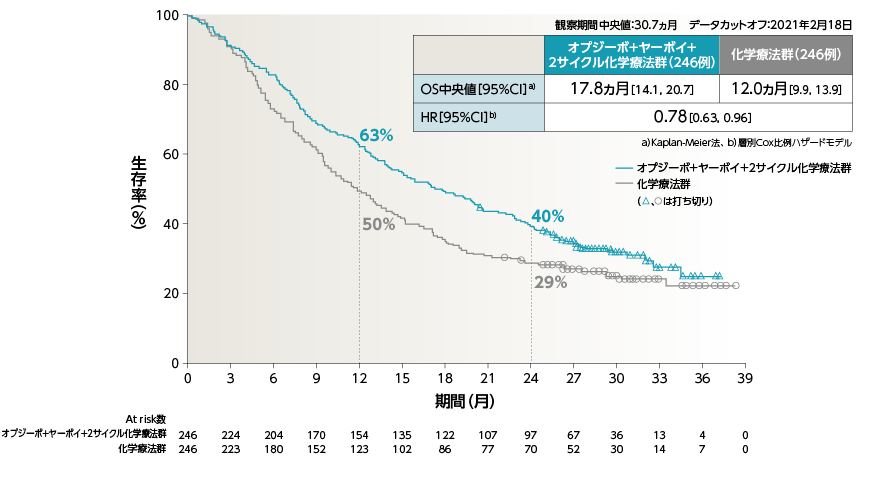
●OS[主要評価項目]
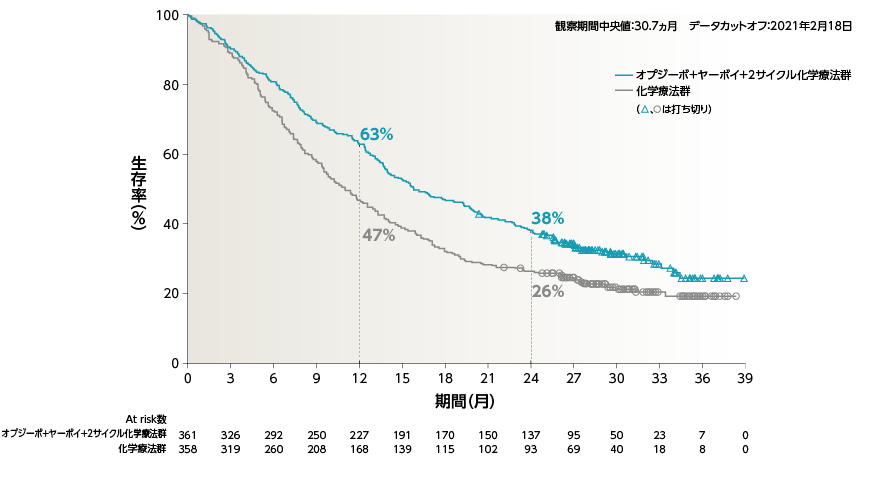

a)Kaplan-Meier法、 b)層別Cox比例ハザードモデル
2年Follow-upにおいて、オプジーボ+ヤーボイ+2サイクル化学療法群の化学療法群に対するOSのHRは0.72でした
2年OS率は、オプジーボ+ヤーボイ+2サイクル化学療法群38%、化学療法群で26%でした1)
1)Reck M, et al. ESMO Open. 2021: 6; 100273
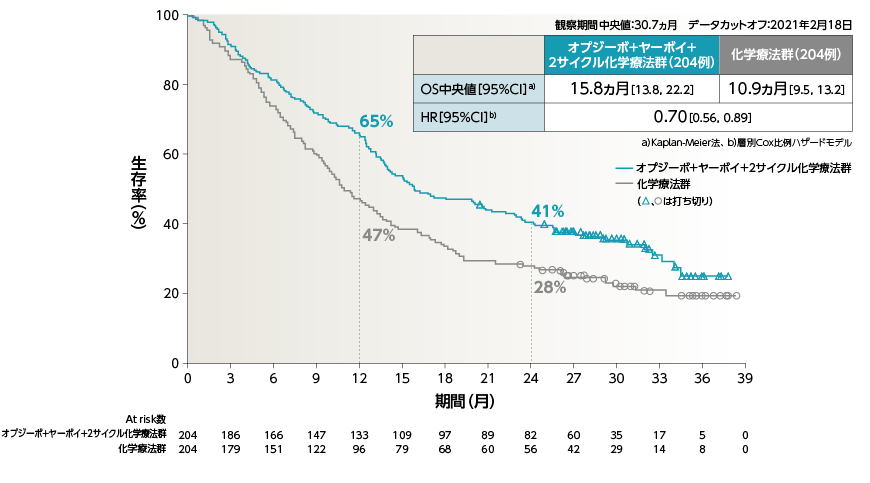
●OS(PD-L1≧1%)[主要評価項目・サブグループ解析]
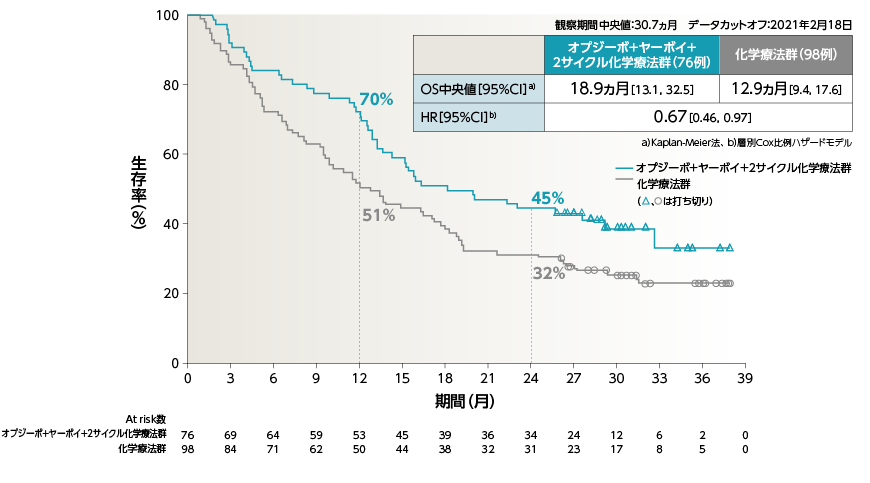
●OS(PD-L1≧50%)[主要評価項目・サブグループ解析]
●OS(PD-L1<1%)[主要評価項目・サブグループ解析]
●OS[主要評価項目・サブグループ解析]
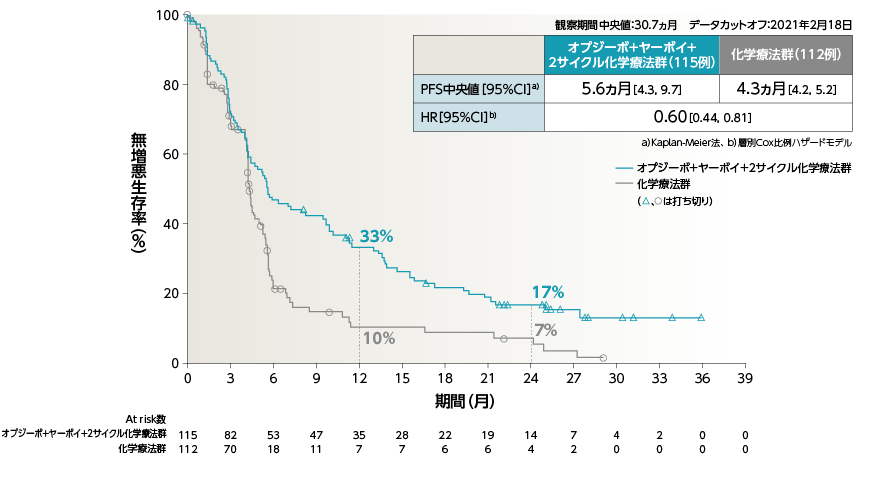
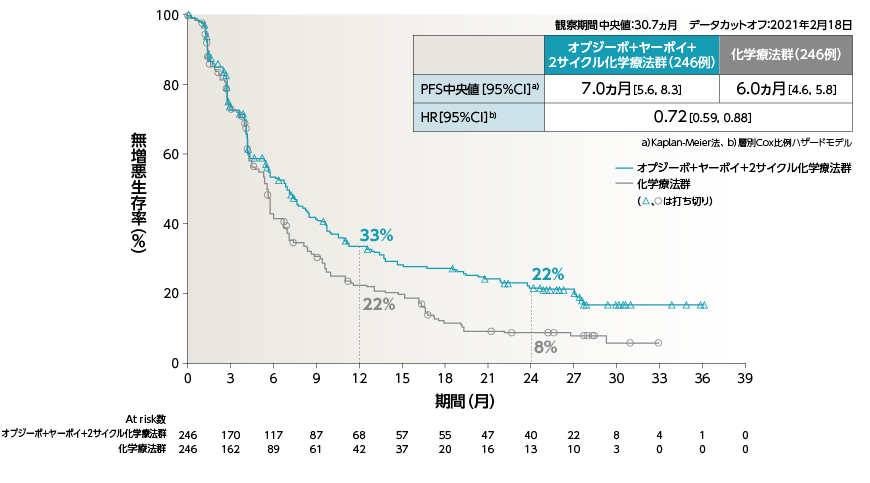
●PFS[副次的評価項目・サブグループ解析]
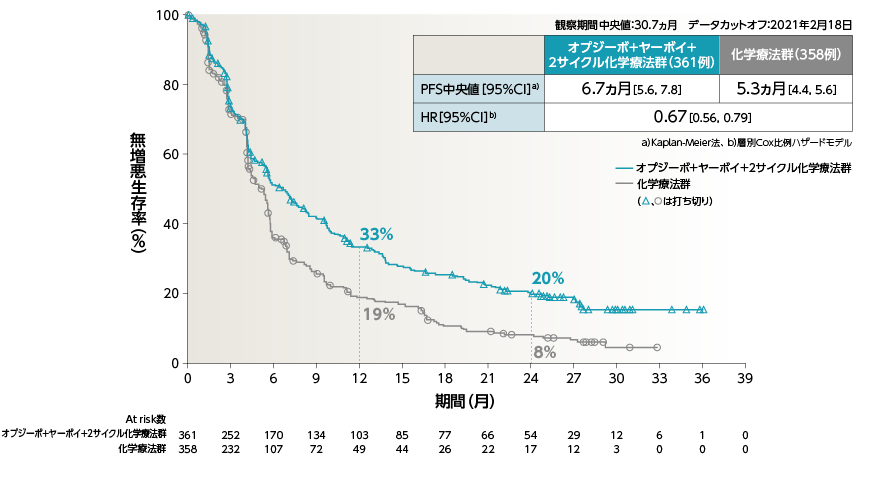
2年Follow-upにおいて、2年PFS率は、オプジーボ+ヤーボイ+2サイクル化学療法群で20%、化学療法群で8%でした
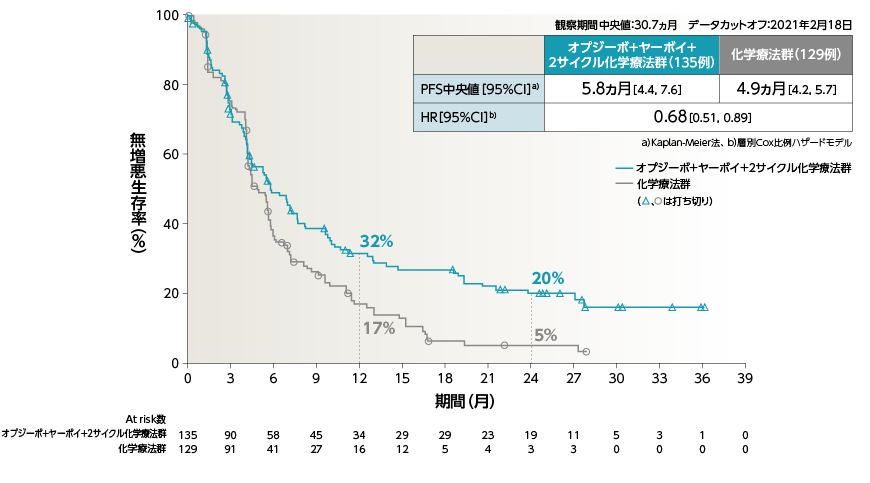
●PFS(PD-L1≧1%)[副次的評価項目・サブグループ解析]
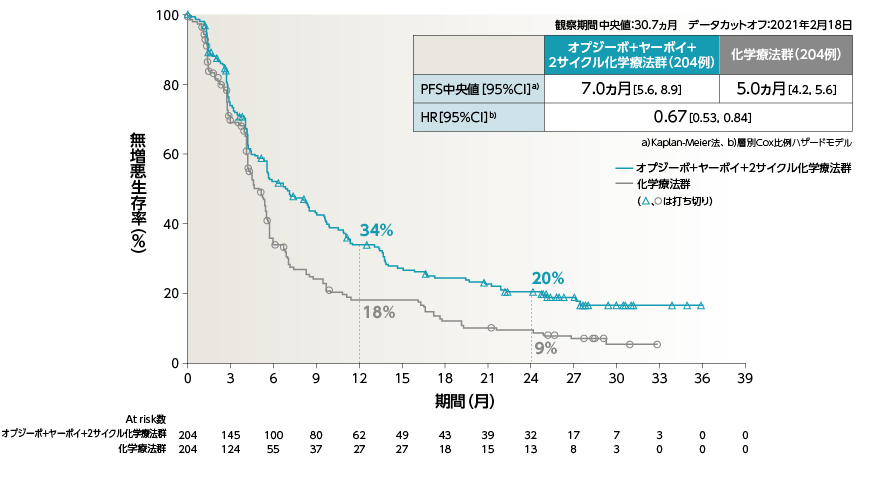
●PFS(PD-L1≧50%)[副次的評価項目・サブグループ解析]
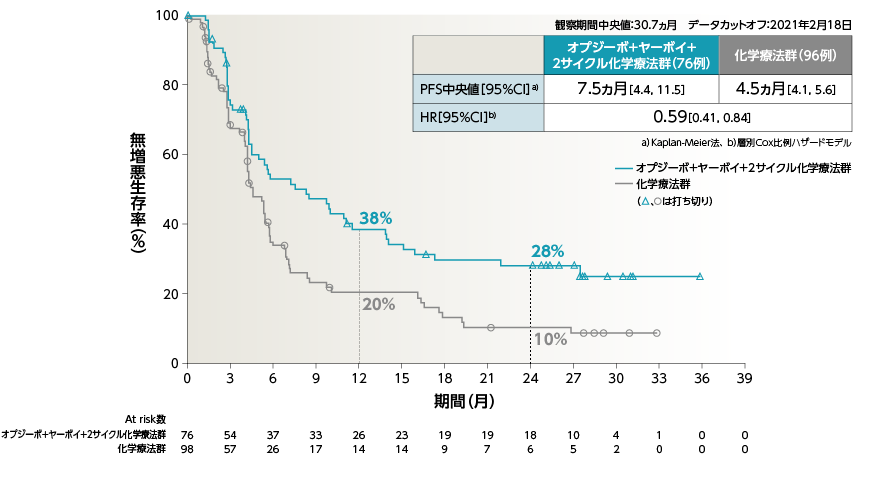
●PFS(PD-L1<1%)[副次的評価項目・サブグループ解析]
●ORRおよびBOR[副次的評価項目]

2年Follow-upにおいて、奏効率はオプジーボ+ヤーボイ+2サイクル化学療法群で38.0%、化学療法群で25.4%でした
●PD-L1発現率別のORRおよびBOR[副次的評価項目・サブグループ解析]
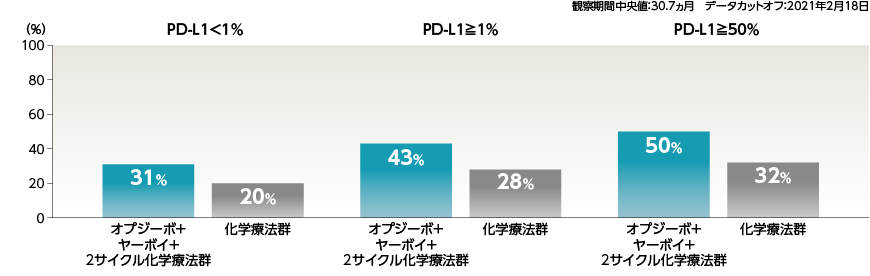

安全性

●主な副作用(いずれかの群で10%以上に発現したもの)
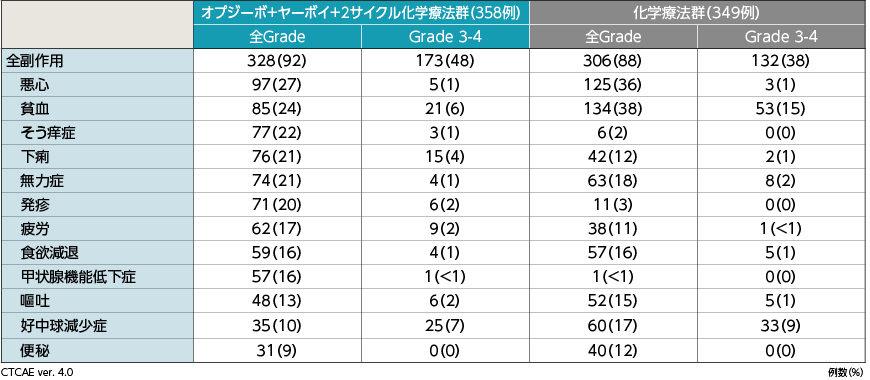
2年Follow-upにおける主な副作用(10%以上)は、オプジーボ+ヤーボイ+2サイクル化学療法群では悪心27%(97例)、貧血24%(85例)、そう痒症22%(77例)、下痢21%(76例)、無力症21%(74例)、発疹20%(71例)、疲労17%(62例)、食欲減退16%(59例)、甲状腺機能低下症16%(57例)、嘔吐13%(48例)、好中球減少症10%(35例)でした。化学療法群では、貧血38%(134例)、悪心36%(125例)、無力症18%(63例)、好中球減少症17%(60例)、食欲減退16%(57例)、嘔吐15%(52例)、下痢12%(42例)、便秘12%(40例)、疲労11%(38例)でした。
中間解析における重篤な副作用は、オプジーボ+ヤーボイ+2サイクル化学療法群29.1%(104例)、化学療法群17.5%(61例)に認められ、主なもの(3%以上)はオプジーボ+ヤーボイ+2サイクル化学療法群では下痢及び発熱性好中球減少症各3.1%(11例)、化学療法群では貧血3.4%(12例)でした。
中間解析における投与中止に至った副作用はオプジーボ+ヤーボイ+2サイクル化学療法群19.0%(68例)、化学療法群7.4%(26例)に認められ、オプジーボ+ヤーボイ+2サイクル化学療法群では主なもの(2%以上)は下痢2.5%(9例)、肺臓炎2%(7例)、化学療法群では主なもの(0.9%以上)は貧血0.9%(3例)でした。
中間解析における本試験において死亡に至った副作用はオプジーボ+ヤーボイ+2サイクル化学療法群では敗血症、急性腎障害、血小板減少症、下痢及び全身健康状態悪化各0.3%(1例)、化学療法群では呼吸不全、敗血症、貧血、汎血球減少症、肺敗血症、発熱性好中球減少症及び突然死各0.3%(1例)でした。
●内分泌障害以外の免疫介在性有害事象の発現率・回復率

●内分泌障害の免疫介在性有害事象の発現率・回復率
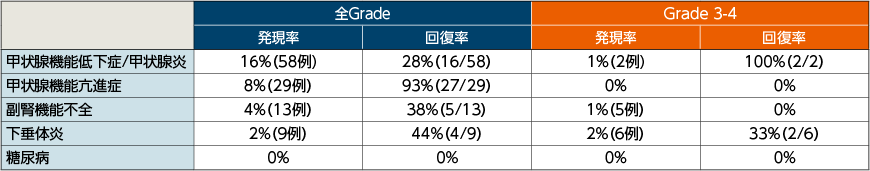
有害事象が消失またはベースライン時点のGradeまで改善した場合を回復と定義した。
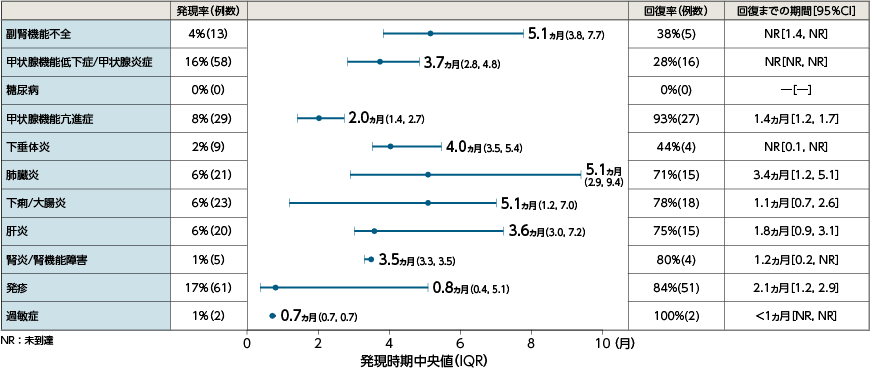
●免疫介在性有害事象の発現時期と回復時期
その他
●後治療の概要

●OS(扁平上皮癌)[主要評価項目・サブグループ解析]
●PFS(扁平上皮癌)[副次的評価項目・サブグループ解析]
●ORR(扁平上皮癌)[副次的評価項目・サブグループ解析]

●OS(非扁平上皮癌)[主要評価項目・サブグループ解析]
●PFS(非扁平上皮癌)[副次的評価項目・サブグループ解析]
●ORR(非扁平上皮癌)[副次的評価項目・サブグループ解析]

4. 効能又は効果(一部抜粋)
切除不能な進行・再発の非小細胞肺癌
5. 効能又は効果に関連する注意(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
5.2 臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.3 本剤の術後補助療法における有効性及び安全性は確立していない。
6. 用法及び用量(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋) 〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈切除不能な進行・再発の非小細胞肺癌〉
7.3 化学療法未治療患者に対する本剤単独投与の有効性及び安全性は確立していない。
7.4 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は、「17. 臨床成績」の項の内容を熟知し、臨床試験において検討された患者のPD-L1発現率を考慮した上で選択すること。

















