ONO4538-52試験

非扁平上皮非小細胞肺癌(NSCLC)に対してオプジーボ+カルボプラチン+パクリタキセル+ベバシズマブ併用療法が使用可能になりました
NSCLC 一次治療におけるオプジーボを含むレジメン

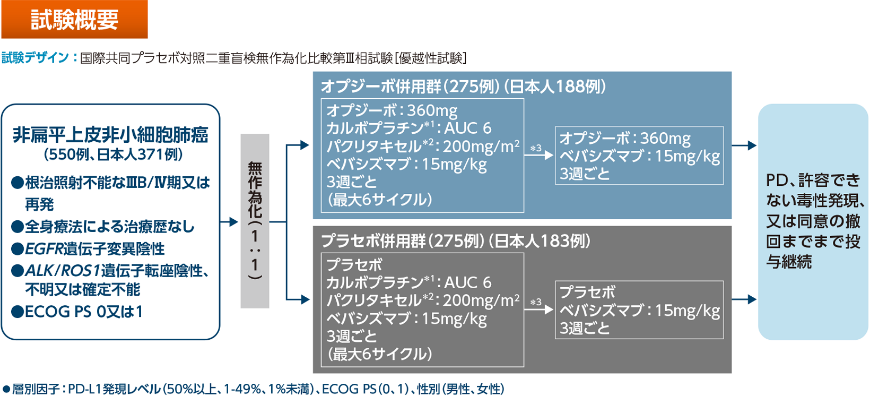
ONO-4538-52試験について
- 対象は、非扁平上皮NSCLCです。
- 目的は、オプジーボ併用群のプラセボ併用群に対する優越性の検証と安全性の検討です。
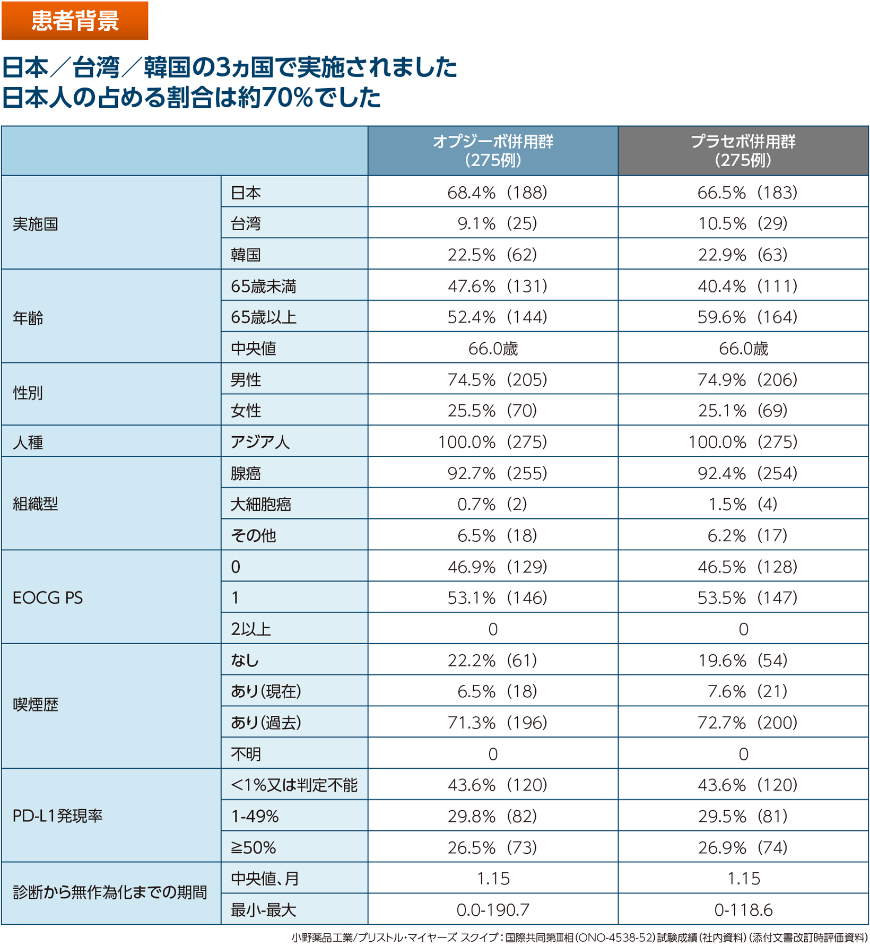
- 日本/台湾/韓国で実施され、日本人の割合は約70%でした。
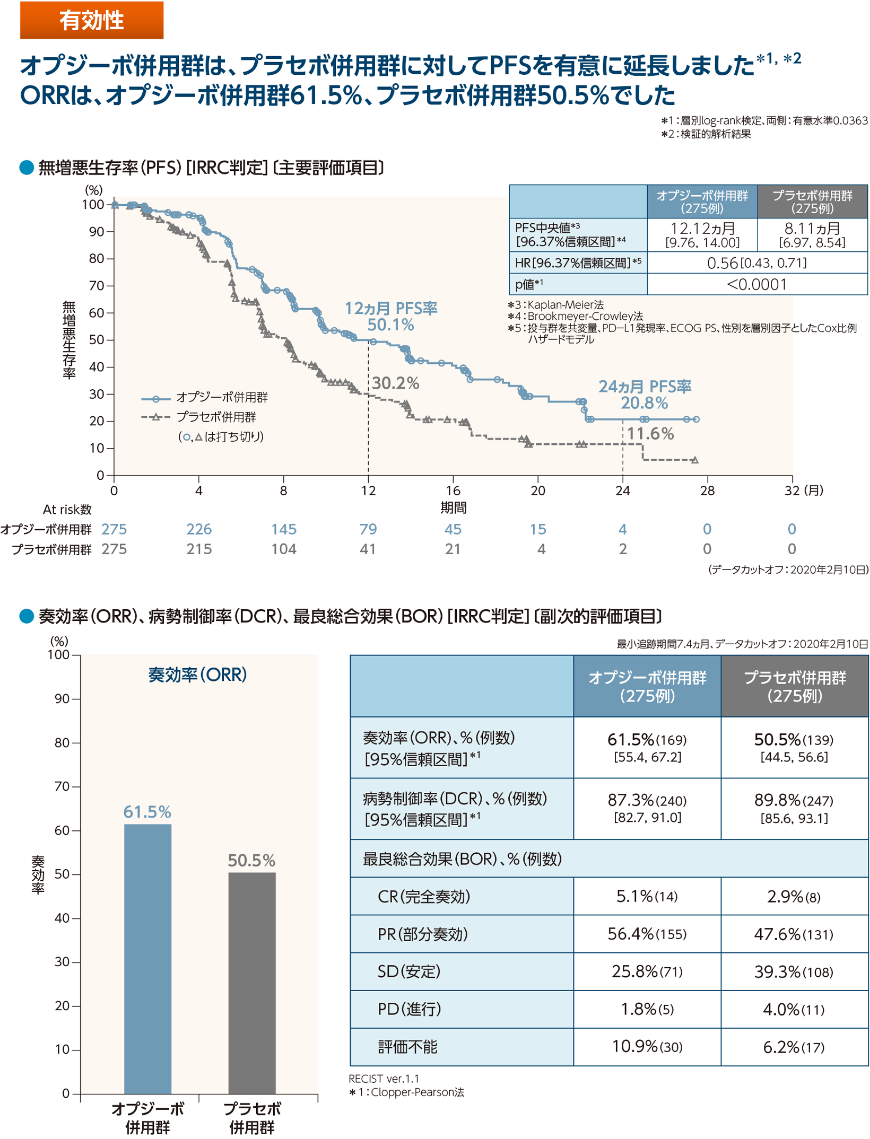
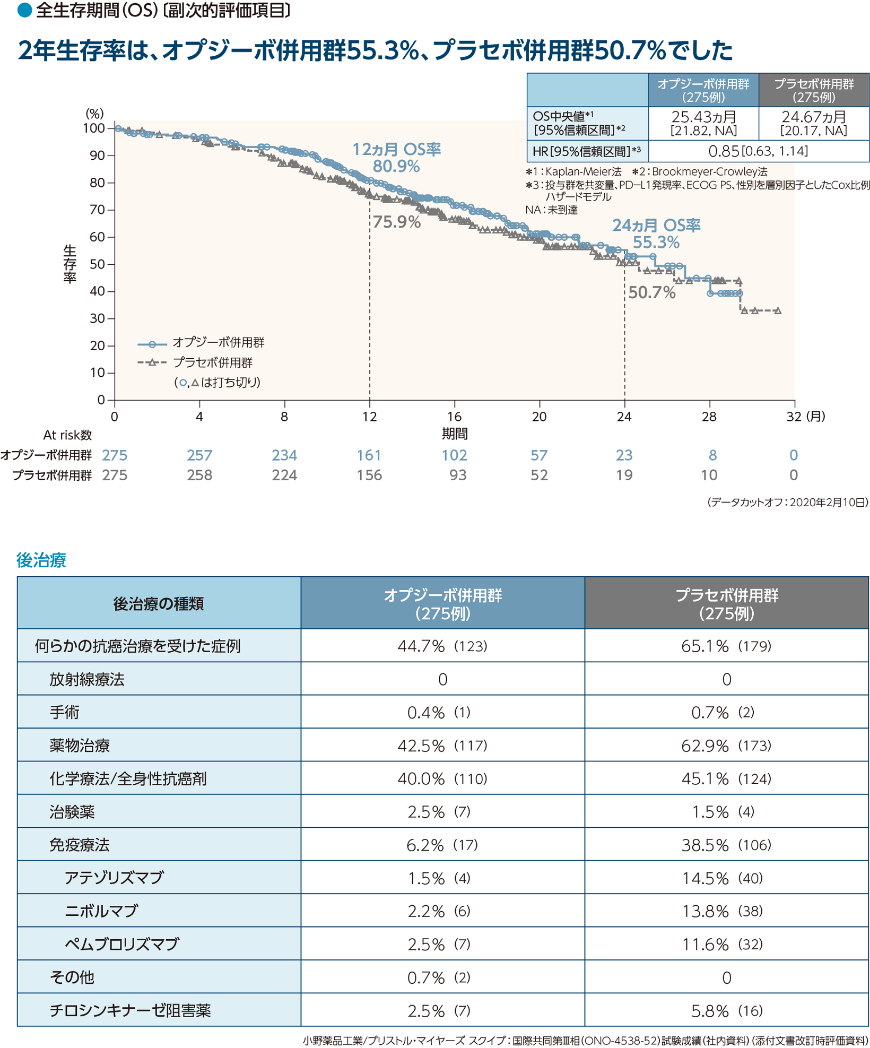
- オプジーボ併用群はプラセボ併用群に対して無増悪生存期間(PFS)を有意に延長しました*1,*2。
*1:検証的解析結果
*2:p<0.0001、層別log-rank検定、両側:有意水準0.0363
- PFS中央値はオプジーボ併用群で12.12ヵ月、プラセボ併用群で8.11ヵ月であり、オプジーボ併用群のプラセボ併用群に対するハザード比は0.56*3でした
*3:投与群を共変量、PD-L1発現率、ECOG PS、性別を層別因子としたCox比例ハザードモデル
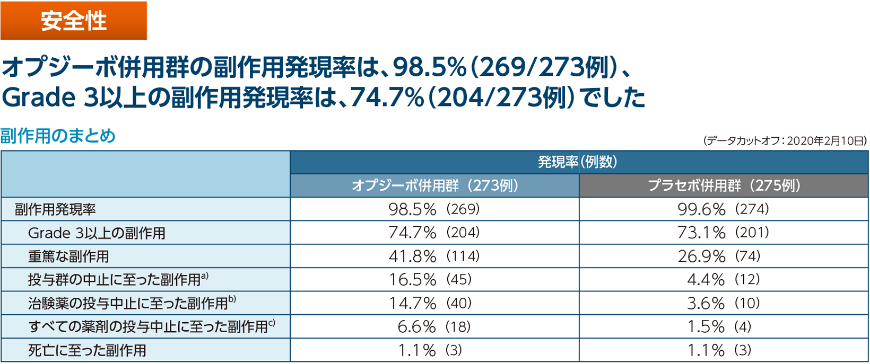
- 副作用発現率は、オプジーボ併用群で98.5%(269/273例)、プラセボ併用群で99.6%(274/275例) でした。
4. 効能又は効果(一部抜粋)
切除不能な進行・再発の非小細胞肺癌
5. 効能又は効果に関連する注意(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
5.1 臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17.
臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.9、17.1.10、17.1.11参照]
6. 用法及び用量(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈切除不能な進行・再発の非小細胞肺癌〉
7.7 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は、「17. 臨床成績」の項の内容を熟知し、臨床試験において検討された患者のPD-L1発現率を考慮した上で選択すること。[17.1.10参照]
8. 重要な基本的注意
〈切除不能な進行・再発の非小細胞肺癌〉
8.9
本剤とカルボプラチン、パクリタキセル及びベバシズマブ(遺伝子組換え)を併用投与する際には、発熱性好中球減少症があらわれることがあるので、必要に応じて血液検査を行う等、患者の状態を十分に観察すること。[11.1.5参照]
化学療法未治療のEGFR遺伝子変異陰性、ALK融合遺伝子陰性及びROS1融合遺伝子陰性の切除不能な進行・再発の非扁平上皮NSCLCを対象とした国際共同第Ⅲ相
ONO-4538-52試験
本邦におけるカルボプラチンの用法及び用量(一部抜粋)は「頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌の場合:通常、成人にはカルボプラチンとして、1日1回300~400mg/m(2体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、年齢、疾患、症状により適宜増減する。」である。
本邦におけるパクリタキセルの用法及び用量(一部抜粋)は「、非小細胞肺癌及び子宮体癌にはA法を使用する。A法:通常、成人にはパクリタキセルとして、1日1回210mg/m(2体表面積)を3時間かけて点滴静注し、少なくとも3週間休薬する。これを1クールとして、投与を繰り返す。」である。
SD以上であればオプジーボ/ベバシズマブ併用投与、又はプラセボ/ベバシズマブ併用投与を継続する。
【目的】
化学療法未治療のEGFR遺伝子変異陰性、ALK融合遺伝子陰性及びROS1融合遺伝子陰性の切除不能な進行・再発の非扁平上皮非小細胞肺癌を対象として、オプジーボ、カルボプラチン、パクリタキセル及びベバシズマブの併用療法(オプジーボ併用群)のプラセボ、カルボプラチン、パクリタキセル及びベバシズマブの併用療法(プラセボ併用群)に対する優越性を検証するとともに、安全性も検討する。
【評価項目】
有効性
主要評価項目:無増悪生存期間(PFS)〔IRRC*4判定〕*5
副次的評価項目:全生存期間(OS)、PFS〔実施医療機関の医師判定〕*5、奏効率(ORR)〔IRRC判定及び実施医療機関の医師判定〕*5、病
勢制御率(DCR)〔IRRC判定及び実施医療機関の医師判定〕*5、奏効期間(DOR)〔IRRC判定〕*5、奏効に至るまでの期間〔IRRC判定〕*5、最良総合効果(BOR)〔IRRC判定及び実施医療機関の医師判定〕*5など
*4:独立画像判定委員会
*5:RECISTガイドライン1.1版に従い判定
安全性
有害事象、臨床検査、バイタルサイン、胸部X線、12誘導心電図、ECOG Performance Status(PS)
【解析計画】
主要評価項目
PFS(IRRC判定)の解析は、Intention-to-Trea(t ITT)を解析対象集団として280件のイベント(最終解析時の目標イベント数の約82.4%)が観察された時点で1回の中間解析を行い、340件のイベントが観察された時点で最終解析を行う計画とした。中間解析及び最終解析の有意水準は、実際のイベント数に基づきLan-DeMets法のα消費関数(O’Brien-Fleming型)を用いて算出することとした。PFS(IRRC判定)の中間解析を306件のイベントが観察された時点で実施し、両側有意水準は0.0363と算出された。この解析でオプジーボ併用群のプラセボ併用群に対する優越性が検証されたことから、独立データモニタリング委員会により試験の有効中止が勧告され、中間解析を本試験の最終解析と位置付けた。ITTを対象に、PD-L1発現レベル、ECOG PS及び性別を層別因子とした層別log-rank検定により投与群間の比較を行った。オプジーボ併用群のプラセボ併用群に対するハザード比(HR)及びその両側96.37%信頼区間を、投与群を共変量とし、PD-L1発現レベル、ECOG PS及び性別を層別因子としたCox比例ハザードモデルを用いて推定した。
PFSのKaplan-Meier曲線を投与群別に示し、PFS中央値を投与群別にKaplan-Meier法を用いて推定、その両側96.37%信頼区間をBrookmeyer-Crowley法を用いて算出した。6、12、18及び24ヵ月時点のPFS率を投与群別にKaplan-Meier法を用いて推定し、その両側95%信頼区間をGreenwoodの公式を用いて算出した。
副次的評価項目
記述的解析としてオプジーボ併用群とプラセボ併用群のOS、ORR、BOR、DCRの比較を行った。 OSは、ITTを対象に、PD-L1発現レベル、ECOG PS及び性別を層別因子とした層別log-rank検定を用いて、オプジーボ併用群とプラセボ併用群を比較した。オプジーボ併用群のプラセボ併用群に対するHR及びその両側95%信頼区間を、投与群を共変量とする層別Cox比例ハザードモデルを用いて推定した。OSのKaplan-Meier曲線を投与群別に示し、また、OS中央値を投与群別にKaplan-Meier法を用いて推定、その両側95%信頼区間をBrookmeyer-Crowley法を用いて算出した。6、12、18及び24ヵ月時点のOS率を投与群別にKaplan-Meier法を用いて推定し、その両側95%信頼区間をGreenwoodの公式を用いて算出した。
ORRは、ITTを対象に投与群別に算出し、その両側95%信頼区間をClopper-Pearson法を用いて算出した。PD-L1発現レベル、ECOG PS及び性別を層別因子としたCochran-Mantel-Haenszel検定を用いて、ORRを投与群間で比較し、オプジーボ併用群のプラセボ併用群に対するオッズ比及びその両側95%信頼区間、相対リスク及びその両側95%信頼区間並びにORRの群間差及びその両側95%信頼区間を算出した。DCRの解析方法はORRに準じた。
BORは、完全奏効(CR)、部分奏効(PR)、安定(SD)、進行(PD)及び評価不能(NE)の割合を投与群別に算出し、CR、PR及びSDの各割合に対する両側95%信頼区間をClopper-Pearson法を用いて算出した。
サブグループ解析
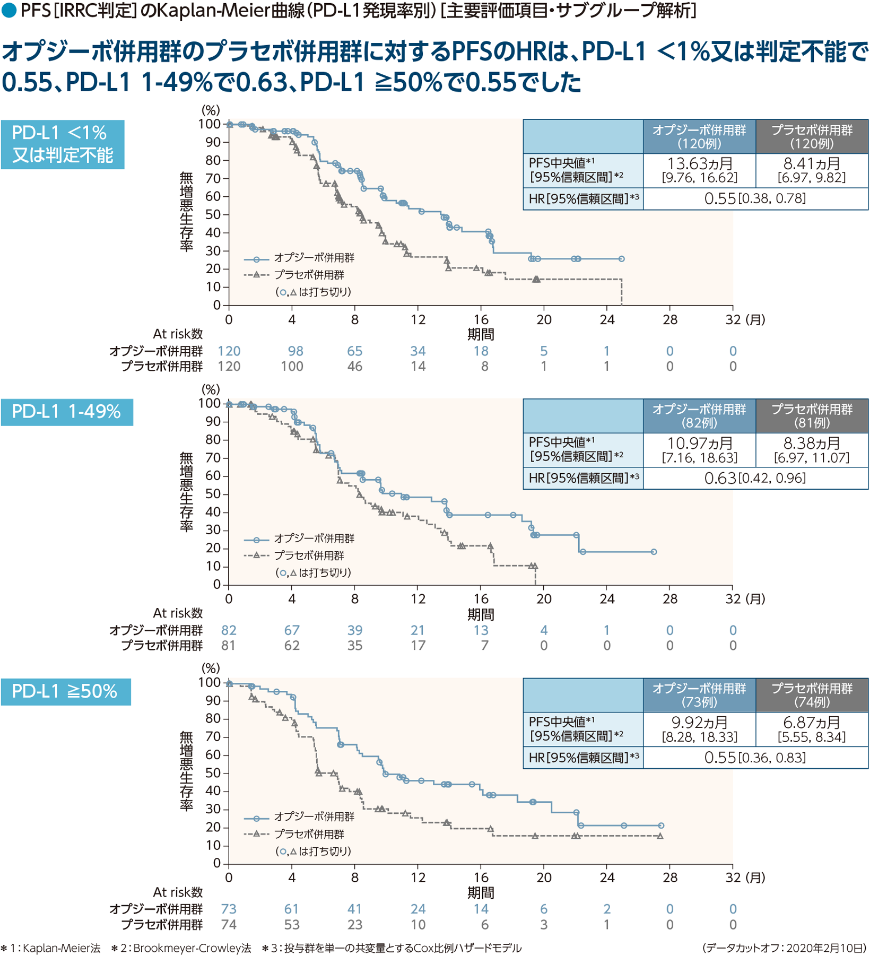
事前に規定された日本人部分集団、PD-L1発現率別(<1%又は判定不能、1-49%、≧50%)のサブグループ解析を行った。
小野薬品工業/ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-52)試験成績(社内資料)
6. 用法及び用量(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈切除不能な進行・再発の非小細胞肺癌〉
7.7 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は、「17. 臨床成績」の項の内容を熟知し、臨床試験において検討された患者のPD-L1発現率を考慮した上で選択すること。[17.1.10参照]
8. 重要な基本的注意
〈切除不能な進行・再発の非小細胞肺癌〉
8.9
本剤とカルボプラチン、パクリタキセル及びベバシズマブ(遺伝子組換え)を併用投与する際には、発熱性好中球減少症があらわれることがあるので、必要に応じて血液検査を行う等、患者の状態を十分に観察すること。[11.1.5参照]
6. 用法及び用量(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈切除不能な進行・再発の非小細胞肺癌〉
7.7 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は、「17.
臨床成績」の項の内容を熟知し、臨床試験において検討された患者のPD-L1発現率を考慮した上で選択すること。[17.1.10参照]
8. 重要な基本的注意
〈切除不能な進行・再発の非小細胞肺癌〉
8.9
本剤とカルボプラチン、パクリタキセル及びベバシズマブ(遺伝子組換え)を併用投与する際には、発熱性好中球減少症があらわれることがあるので、必要に応じて血液検査を行う等、患者の状態を十分に観察すること。[11.1.5参照]
- 投与群の中止に至った副作用は、投与群の最後の薬剤の投与中止に至った副作用と定義した。
- 治験薬(オプジーボ又はプラセボ)の投与中止に至った副作用は、治験薬に対する処置が「Drug Withdrawn(投与中止)」である副作用と定義した。
- すべての薬剤の投与中止に至った副作用は、治験薬及びすべての化学療法に対する処置が「Drug Withdrawn(投与中止)」である副作用と定義した。
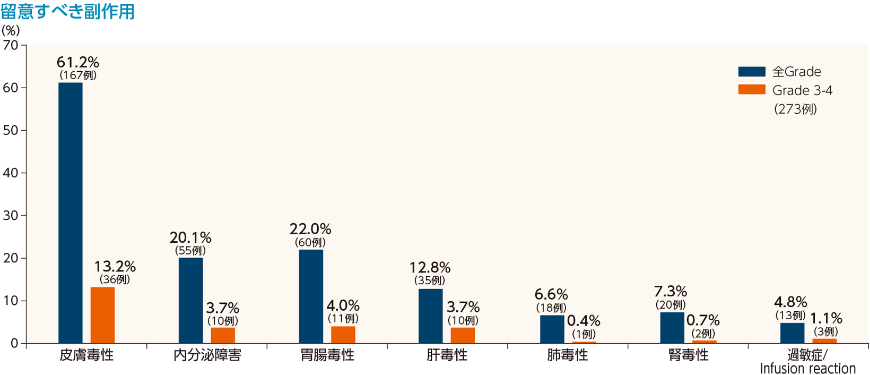
留意すべき副作用は、免疫介在性の可能性があり、頻回なモニタリングと介入を必要とする副作用です。
6. 用法及び用量(一部抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
他の抗悪性腫瘍剤と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回360mgを3週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈切除不能な進行・再発の非小細胞肺癌〉
7.7 他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は、「17. 臨床成績」の項の内容を熟知し、臨床試験において検討された患者のPD-L1発現率を考慮した上で選択すること。[17.1.10参照]
8. 重要な基本的注意
〈切除不能な進行・再発の非小細胞肺癌〉
8.9
本剤とカルボプラチン、パクリタキセル及びベバシズマブ(遺伝子組換え)を併用投与する際には、発熱性好中球減少症があらわれることがあるので、必要に応じて血液検査を行う等、患者の状態を十分に観察すること。[11.1.5参照]
臨床検査値異常変動を含む副作用はオプジーボ併用群で98.5%(269/273例)、プラセボ併用群で99.6%(274/275例)に認められました。
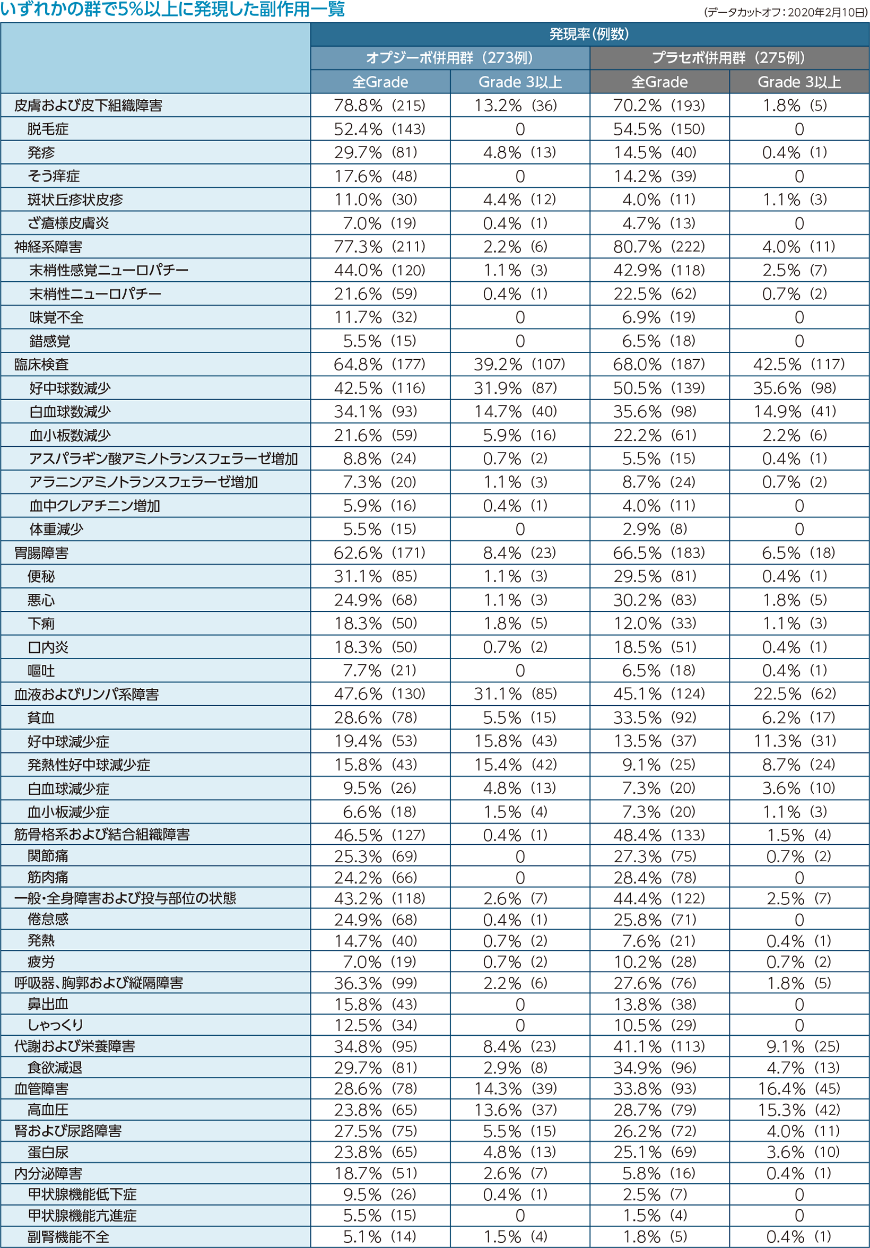
重篤な副作用はオプジーボ併用群で41.8%(114例)、プラセボ併用群で26.9%(74例)に認められ、主なもの(3%以上)は、オプジーボ併用群では発熱性好中球減少症9.5%(26例)、発熱4.0%(11例)、肺臓炎3.3%(9例)、プラセボ併用群では発熱性好中球減少症4.4%(12例)でした。
投与中止に至った副作用として、投与群の中止に至った副作用(投与群の最後の薬剤の投与中止に至った副作用)、治験薬(オプジーボ又はプラセボ)の投与中止に至った副作用、〈治験薬に対する処置が「Drug
Withdrawn(投与中止)」である副作用〉、並びにすべての薬剤の投与中止に至った副作用〈治験薬及びすべての化学療法に対する処置が「Drug Withdrawn(投与中止)」である副作用〉を集計しました。
投与群の中止に至った副作用は、オプジーボ併用群16.5%(45例)、プラセボ併用群4.4%(12例)に認められ、最も発現率の高かったものはオプジーボ併用群では肺臓炎2.2%(6例)、プラセボ併用群では大腸炎、腸炎、腸管穿孔、大腸穿孔、アナフィラキシー反応、肺炎、クレブシエラ菌性肺炎、食欲減退、筋力低下、末梢性ニューロパチー、急性腎障害、急性間質性肺臓炎、喀血及び間質性肺疾患各0.4%(1例)でした。
治験薬の投与中止に至った副作用は、オプジーボ併用群14.7%(40例)、プラセボ併用群3.6%(10例)に認められ、最も発現率が高かったものは、オプジーボ併用群では肺臓炎2.2%(6例)、プラセボ併用群では間質性肺疾患0.7%(2例)でした。
すべての薬剤の投与中止に至った副作用は、オプジーボ併用群6.6%(18例)、プラセボ併用群1.5%(4例)に認められ、最も発現率が高かったものは、オプジーボ併用群では発疹1.1%(3例)、プラセボ併用群では肺炎,クレブシエラ菌性肺炎,食欲減退及び筋力低下各0.4%(1例)でした。
最終投与後30日までに治験薬又は化学療法の毒性により死亡した被験者の割合はオプジーボ併用群1.1%(3例)、プラセボ併用群1.1%(3例)でした。内訳は、オプジーボ併用群では発熱性好中球減少症、敗血症及び喀血が各1例、プラセボ併用群では上部消化管出血、クレブシエラ菌性肺炎及び敗血症が各1例でした。
オプジーボの副作用
重大な副作用として、間質性肺疾患、重症筋無力症、心筋炎、筋炎、横紋筋融解症、大腸炎、小腸炎、重度の下痢、1型糖尿病、重篤な血液障害、肝不全、肝機能障害、肝炎、硬化性胆管炎、甲状腺機能障害、下垂体機能障害、神経障害、腎障害、副腎障害、脳炎、重度の皮膚障害、静脈血栓塞栓症、Infusion reaction、血球貪食症候群、結核、膵炎が報告されています。
〈単独投与〉
主な副作用(5%以上に発現)は、下痢、悪心、疲労、無力症、発熱、食欲減退、関節痛、そう痒症、発疹でした。
〈併用投与〉
主な副作用(5%以上に発現)は、貧血、好中球減少症、血小板減少症、白血球減少症、下痢、悪心、嘔吐、便秘、疲労、発熱、無力症、食欲減退、高リパーゼ血症、高アミラーゼ血症、関節痛、筋肉痛、そう痒症、 発疹、丘疹性皮疹、脱毛症でした。
添付文書の副作用及び臨床成績の安全性の結果をご参照ください。
オプジーボ添付文書2021年6月改訂(第7版)



















