NCCN guideline ver.3

NCCN 肺癌診療ガイドライン version 3.2021
治療アルゴリズム
-
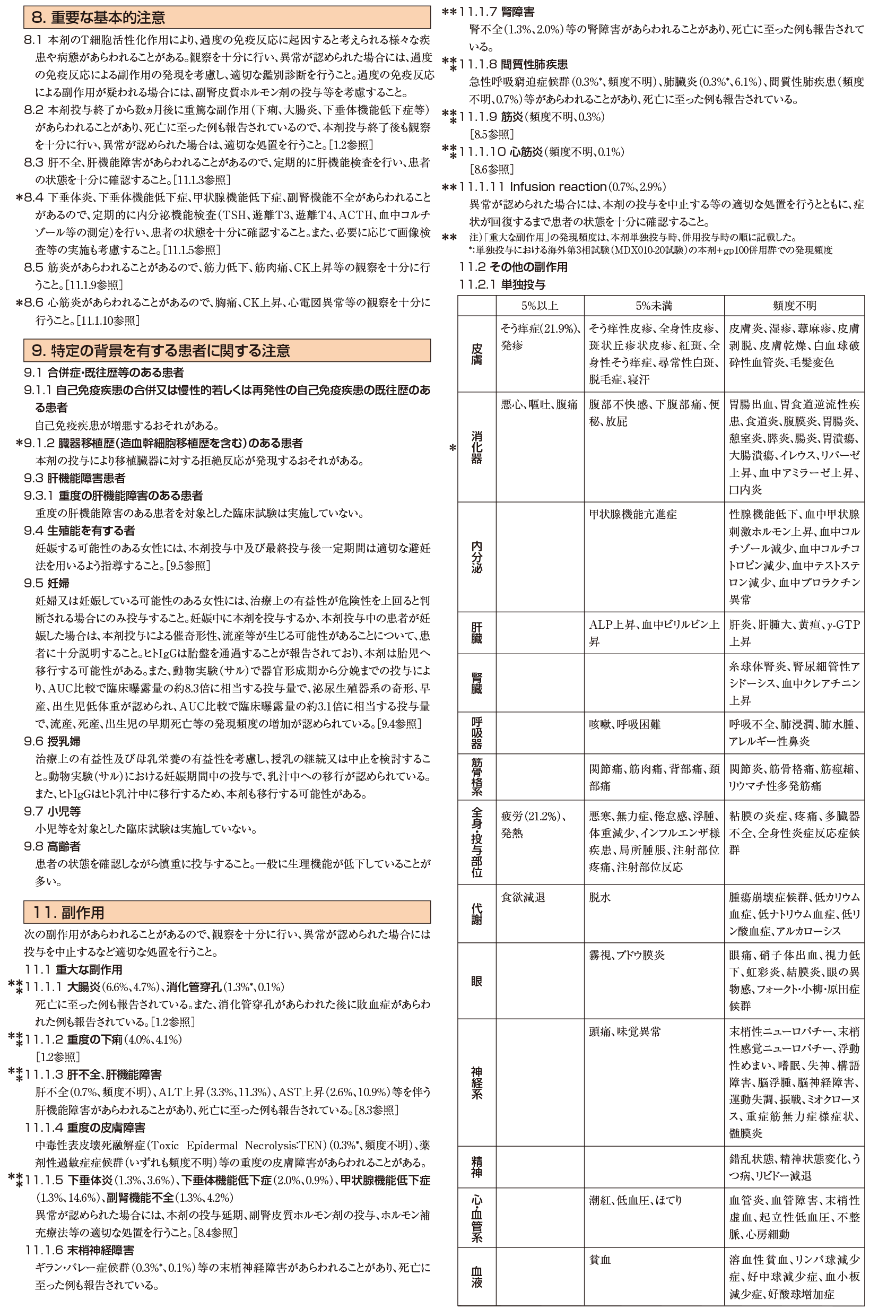
Principles of Molecular and Biomarker Analysis(NSCL-H)を参照
-
Targeted Therapy or Immunotherapy for Advanced or Metastatic Disease(NSCL-J)を参照
-
FDA承認のバイオシミラーはベバシズマブの適正な代替薬である
-
PD-1/PD-L1阻害薬の禁忌には、活動性又は過去に確認された自己免疫疾患及び/又は免疫抑制薬の同時使用、又はオンコジーンの存在が含まれると考えられる(治療のベネフィットが得られないと予測される)。もし、禁忌があればNSCL-K 1 of 5(腺癌)又はNSCL-K 2 of 5(扁平上皮癌)を参照
-
ペムブロリズマブ単剤の投与を受けた場合
-
ペムブロリズマブ/カルボプラチン/ペメトレキセド、又はペムブロリズマブ/シスプラチン/ペメトレキセドの投与を受けた場合
-
アテゾリズマブ/カルボプラチン/パクリタキセル/ベバシズマブの投与を受けた場合
-
アテゾリズマブ/カルボプラチン/nab-パクリタキセル又はアテゾリズマブの投与を受けた場合(アテゾリズマブ単剤後に投与した場合はcategory 1)
-
ニボルマブ+イピリムマブ±化学療法の投与を受けた場合
-
プラチナ製剤を含む2剤化学療法を受けていない場合は「全身療法」を参照、プラチナ製剤を含む化学療法とPD-1/PD-L1阻害薬を受けた場合は「後治療」を参照
-
ペムブロリズマブ/カルボプラチン/(パクリタキセル又はnab-パクリタキセル)の投与を受けた場合
NSCL-31
注意:特に指定のない限り、すべての推奨はcategory 2Aである。
臨床試験:NCCNは、すべてのがん患者にとって最良の管理法は臨床試験にあると考えている。臨床試験への参加が特に推奨される。
-
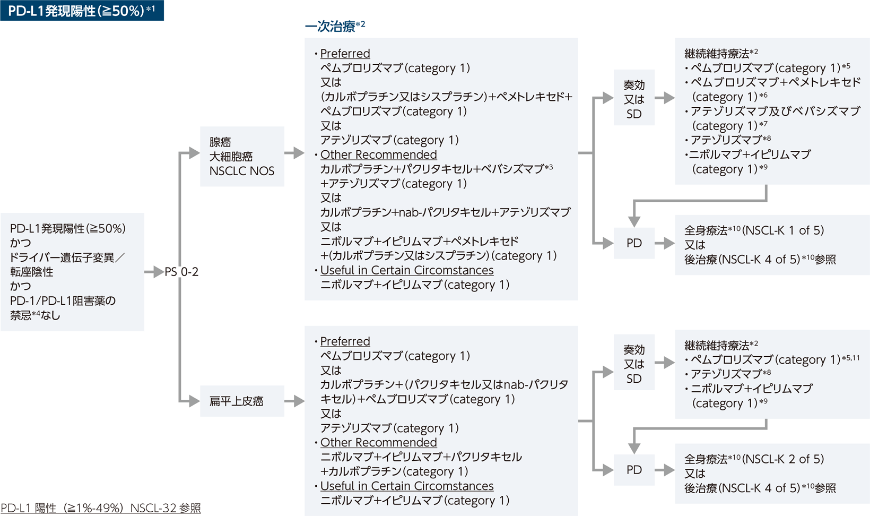
Principles of Molecular and Biomarker Analysis(NSCL-H)を参照
-
Targeted Therapy or Immunotherapy for Advanced or Metastatic Disease(NSCL-J)を参照
-
FDA承認のバイオシミラーはベバシズマブの適正な代替薬である
PD-1/PD-L1阻害薬の禁忌には、活動性又は過去に確認された自己免疫疾患及び/又は免疫抑制薬の同時使用、又はオンコジーンの存在が含まれると考えられる(治療のベネフィットが得られないと予測される)。もし、禁忌があればNSCL-K 1 of 5(腺癌)又はNSCL-K 2 of 5(扁平上皮癌)を参照
ペムブロリズマブ単剤の投与を受けた場合
ペムブロリズマブ/カルボプラチン/ペメトレキセド、又はペムブロリズマブ/シスプラチン/ペメトレキセドの投与を受けた場合
アテゾリズマブ/カルボプラチン/パクリタキセル/ベバシズマブの投与を受けた場合
アテゾリズマブ/カルボプラチン/nab-パクリタキセルの投与を受けた場合
ニボルマブ+イピリムマブ±化学療法の投与を受けた場合
プラチナ製剤を含む2剤化学療法を受けていない場合は「全身療法」を参照、プラチナ製剤を含む化学療法とPD-1/PD-L1阻害薬を受けた場合は「後治療」を参照
ペムブロリズマブ/カルボプラチン/(パクリタキセル又はnab-パクリタキセル)の投与を受けた場合
PS不良又は化学療法併用療法に対する他の禁忌を有する患者において、PD-L1が1%-49%の場合ペムブロリズマブ単剤を考慮してもよい
NSCL-32
Categoryの説明
NCCNのエビデンスとコンセンサスによるCategory
【Category 1】
高レベルのエビデンスに基づいており、その介入が適切であるというNCCNの統一したコンセンサスが存在する。
【Category 2A】
比較的低レベルのエビデンスに基づいており、その介入が適切であるというNCCNの統一したコンセンサスが存在する。
【Category 2B】
比較的低レベルのエビデンスに基づいており、その介入が適切であるというNCCNのコンセンサスが存在する。
【Category 3】
いずれかのレベルのエビデンスに基づいてはいるが、その介入が適切であるという点でNCCN内の大きな意見の不一致がある。
※特に指定のない限り、すべての推奨はCategory 2Aである。
NCCNのPreference Category
【Preferred Intervention】
有効性、安全性及びエビデンス(適切な場合、経済的負担)の優越性に基づいた介入
【Other Recommended Intervention】
比較的低レベルのエビデンスに基づいており、その介入が適切であるというNCCNの統一したコンセンサスが存在する。。
【Useful in Certain Circumstances】
特定の患者集団において用いられる介入(推奨として定義される)
※いずれの介入も適切と考えられる。
NCCN Clinical Practice Guidelines in Oncology, Non-
Small Cell Lung Cancer. Version 3. 2021, February 16,
2021. NCCN.org
NCCN 肺癌診療ガイドライン version 3.2021
治療アルゴリズム
-
一般に、初回全身療法を4サイクル(例:カルボプラチン又はシスプラチン併用)を維持療法の前に投与する。しかし、もし患者の治療に対する忍容性が良好であれば、6サイクル継続することを考慮してもよい。
-
初回治療中のモニタリング:2サイクル投与後に奏効の評価を行い、その後2-4サイクルごと、または臨床的に必要であれば、確認されている病巣部位のCT評価を行う(対照の有無は問わない)。ガイドライン基準内のCT検査時期は臨床的判断による。
-
後治療中のモニタリング:確認されている病巣部位のCT評価を6-12週ごとに行う(対照の有無は問わない)。ガイドライン基準内のCT検査時期は臨床的判断による。
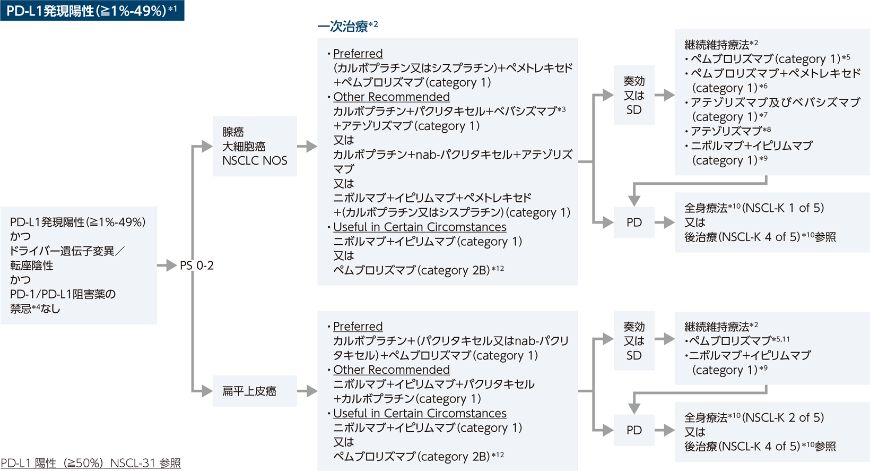
進行又は転移を有する疾患に対する全身療法-初回全身療法の選択肢a,b

前処置を行ったにもかかわらず、パクリタキセル又はドセタキセル投与後に過敏反応を経験した患者、あるいは標準的前処置(デキサメタゾン、H2ブロッカー、H1ブロッカーなど)が禁忌の患者では、nab-パクリタキセルがパクリタキセル又はドセタキセルの代替となると考えられる。
合併症を有する患者又はシスプラチンに不耐の患者にはカルボプラチンを含むレジメンがしばしば使用される。
PD-1/PD-L1阻害薬の禁忌には、活動性又は過去に確認された自己免疫疾患、及び/又は免疫抑制薬の同時使用、又はオンコジーン(例:EGFR[エクソン19欠失、エクソン21 p.L858R点突然変異]、ALK転座、RET転座)など治療ベネフィットが得られないと予測される場合が含まれると考えられる。
PD-1/PD-L1阻害薬による治療中にPDとなった場合、PD-1/PD-L1阻害薬の使用は推奨されない。
FDA承認のバイオシミラーはベバシズマブの適正な代替薬である。
PDまでベバシズマブを投与すべきである。
ベバシズマブと併用する場合、血小板減少症の発症リスクの高い薬剤、及び出血のリスクのある薬剤を含むレジメンの適用時には注意が必要である。
ベバシズマブ治療の使用基準:非扁平上皮NSCLC、最近の喀血の既往なし。維持療法の初期に化学療法と併用した場合を除き、ベバシズマブ単剤投与は行うべきではない。
エトポシド:本邦において非小細胞肺癌の「効能又は効果」はない
進行又は転移を有する疾患に対する全身療法-初回全身療法の選択肢a,b

前処置を行ったにもかかわらず、パクリタキセル又はドセタキセル投与後に過敏反応を経験した患者、あるいは標準的前処置(デキサメタゾン、H2ブロッカー、H1ブロッカーなど)が禁忌の患者では、nab-パクリタキセルがパクリタキセル又はドセタキセルの代替となると考えられる。
合併症を有する患者又はシスプラチンに不耐の患者にはカルボプラチンを含むレジメンがしばしば使用される。
PD-1/PD-L1阻害薬の禁忌には、活動性又は過去に確認された自己免疫疾患、及び/又は免疫抑制薬の同時使用、又はオンコジーン(例:EGFR[エクソン19欠失、エクソン21 p.L858R点突然変異]、ALK転座、RET転座)など治療ベネフィットが得られないと予測される場合が含まれると考えられる。
PD-1/PD-L1阻害薬による治療中にPDとなった場合、PD-1/PD-L1阻害薬の使用は推奨されない。
進行又は転移を有する疾患に対する全身療法-維持療法の選択肢

i:
一次治療においてペメトレキセド/プラチナ製剤とベバシズマブを併用した場合
j:
ペムブロリズマブ/カルボプラチン/ペメトレキセド、又は、ペムブロリズマブ/シスプラチン/ペメトレキセドの投与を受けた場合
k:
アテゾリズマブ/カルボプラチン/パクリタキセル/ベバシズマブの投与を受けた場合
l:
ニボルマブ+イピリムマブ±化学療法の投与を受けた場合
m:
アテゾリズマブ/カルボプラチン/nab-パクリタキセルの投与を受けた場合
n:
ペムブロリズマブ/カルボプラチン/(パクリタキセル又はnab-パクリタキセル)の投与を受けた場合
注意:特に指定のない限り、すべての推奨はcategory 2Aである。
臨床試験:NCCNは、すべてのがん患者にとって最良の管理法は臨床試験にあると考えている。臨床試験への参加が特に推奨される。
References
- Langer CJ, et al. Lancet Oncol. 2016; 17: 1497-1508.
- Gandhi L, et al. N Engl J Med. 2018; 378: 2078-2092.
- Socinski M, et al. N Engl J Med. 2018; 378: 2288-2301.
- West H, et al. Lancet Oncol. 2019; 20: 924-937.
- Hellmann MD, et al. N Engl J Med. 2019; 381: 2020-2031. [利益相反]本研究はBristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
- Paz-Ares L, et al. Lancet Oncol. 2021; 22: 198-211. [利益相反]本研究はBristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
- Sandler A, et al. N Engl J Med. 2006; 355: 2542-2550. [利益相反]著者にBristol-Myers Squibbより講演料、コンサルタント料などを受領しているものが含まれる。
- Patel JD, et al. J Clin Oncol. 2013; 31: 4349-4357.
- Barlesi F, et al. J Clin Oncol. 2013; 31: 3004-3011.
- Socinski MA, et al. J Clin Oncol. 2012; 30: 2055-2062.
- Fossella F, et al. J Clin Oncol. 2003; 21: 3016-3024.
- Klastersky J, et al. J Clin Oncol. 1990; 8: 1556-1562.
- Frasci G, et al. Eur J Cancer. 1998;34: 1710-1714.
- Danson S, et al. Cancer 2003; 98: 542-553.
- Ohe Y, et al. Ann Oncol. 2007; 18: 317-323. [利益相反]本研究はBristol-Myers Squibbの支援を受けて実施された。
- Scagliotti GV, et al. Clin Cancer Res. 2005; 11: 690-696.
- Cardenal F, et al. J Clin Oncol. 1999; 17: 12-18.
- Scagliotti GV, et al. J Clin Oncol. 2008; 26: 3543-3551.
- Schiller JH, et al. N Engl J Med. 2002; 346: 92-98. [利益相反]著者にBristol-Myers Squibbより研究支援、コンサルタント料などを受領しているものが含まれる。
- Pujol JL, et al. Ann Oncol. 2005; 16: 602-610.
- Tan EH, et al. Lung Cancer. 2005; 16: 602-610.
- Green M, et al. Ann Oncol. 2006; 17: 1263-1268.
- Rizvi N, et al. J Clin Oncol. 2008; 26: 639-643.
- Socinski MA, et al. J Clin Oncol. 2012; 30: 2055-2062.
- Fossella FV, et al. J Clin Oncol. 2000; 18: 2354-2362.
- Fidias PM, et al. J Clin Oncol. 2009; 27: 591-598.
- Zatloukal P, et al. Lung Cancer. 1998; 22: 243-250.
- Sederholm C, et al. J Clin Oncol. 2005; 23: 8380-8288.
- Perol M, et al. J Clin Oncol. 2012; 30: 3516-3524.
- Lilenbaum RC, et al. J Clin Oncol. 2005; 23: 190-196. [利益相反]著者にBristol-Myers Squibbよりコンサルタント料などを受領しているものが含まれる。
- Ceresoli GL, et al. Lung Cancer. 2004; 44: 231-239.
- Yasuda K, et al. Oncology. 2004; 66: 347-352.
- Hanna NH, et al. J Clin Oncol. 2004; 22: 1589-1597.
- Paz-Ares L, et al. N Engl J Med. 2018; 379: 2040-2051.