CheckMate 025試験(国際共同第Ⅲ相試験)概要
血管新生阻害薬による治療歴を有する
淡明細胞型腎細胞癌を対象とした国際共同第Ⅲ相試験(CheckMate 025)1-3)
試験概要
試験デザイン
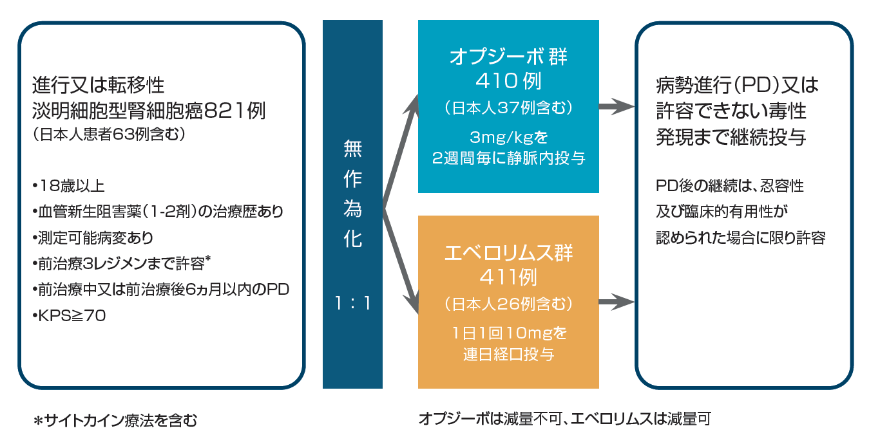
【目的】
血管新生阻害剤による治療歴を有する進行又は転移性淡明細胞型腎細胞癌を対象にオプジーボのエベロリムスに対する優越性を検証するとともに、安全性も検討する。
【試験デザイン】
国際共同非盲検無作為化比較第Ⅲ相試験[優越性試験]
【対象】
1剤又は2剤の血管新生阻害剤を含むレジメンによる治療歴かつ合計3種類以下の全身治療レジメンによる治療歴を有する進行又は転移性淡
明細胞型腎細胞癌患者 821例(日本人63例)
[オプジーボ群:410例(日本人37例)、エベロリムス群:411例(日本人26例)]
【主要評価項】
全生存期間(OS)
【副次的評価項】
奏効率(ORR)[RECISTガイドライン1.1版に基づく試験実施施設の医師判定によるCR及びPRの割合]、無増悪生存期間(PFS)、奏効に至るまでの期間、奏効期間(DOR)、HRQoL等
【安全性】
有害事象、重篤な有害事象など
【解析計画】
[主要評価項目]
全生存期間(OS)について、OSイベントが398件発生した時点で中間解析を行い、主要評価項目の優越性検定をした。有意水準(p値)が0.0148以下であれば有効中止することがあることを事前に規定した(OSイベントが569件発生した後に実施されるOSの最終解析の名目上の優越性の有意水準は0.0455とした)。地域、MSKCCリスク分類及び血管新生阻害剤を含むレジメン数を層別因子とした層別log-rank検定を用いて、2群間を比較した。投与群間のハザード比とその両側98.52%信頼区間は、投与群を単一の共変量とし、上記因子を層別因子とした層別Cox比例ハザードモデルを用いて推定した。また、Kaplan-Meier曲線を示し、Kaplan-Meier法を用いて中央値を推定、その95%信頼区間はBrookmeyer-Crowley法を用いて推定した。実際の解析はフォローアップの追跡期間に応じて実施した(14、36、40、48、60、64ヵ月時点)。
[副次的評価項目]
最良総合効果(BOR)について、投与群ごとにCR、PR、SD、PD及びNE(評価不能)の例数及びその割合を算出した。奏効率(ORR)は、地域、MSKCCリスク分類及び血管新生阻害剤を含むレジメン数を層別因子としたCochran-Mantel-Haenszel検定を用いて2群間を比較した。関連するオッズ比及び95%信頼区間を算出した。ORR及び95%信頼区間をClopper-Pearson法を用いて計算した。無増悪生存期間(PFS)は、地域、MSKCCリスク分類及び血管新生阻害剤を含むレジメン数を層別因子とした層別log-rank検定を用いて2群間を比較した。
オプジーボのエベロリムスに対するハザード比及び両側95%信頼区間は、投与群を単一の共変量とし、上記因子を層別因子とした層別Cox比例ハザードモデルを用いて推定した。奏効期間(DOR)は、奏効が認められた患者を対象にKaplan-Meier法を用いて中央値を推定し、その両側95%信頼区間はBrookmeyer-Crowley法を用いて算出した。奏効に至るまでの期間は、奏効が認められた患者を対象にKaplan-Meier法を用いて推定した。HRQoLはFKSI-DRS質問票の回答率(投与中又は追跡調査中の被験者数に占める実際に質問票を受け取った被験者数の割合)を計算し、各評価時点で集計した。ORR、PFS、DOR、奏効に至るまでの期間及びHRQoLについて、実際の解析はフォローアップの追跡期間に応じて実施した(14、36、40、48、60、64ヵ月時点)。
[サブグループ解析]
事前に規定された日本人部分集団を対象としたサブグループ解析を行った。また、全症例及び日本人部分集団において、事前に規定された部分解析集団(MSKCCリスク分類、レジメン数、地域、年齢、性別、人種など)に対する全生存期間(OS)、奏効率(ORR)、最良総合効果(BOR)、無増悪生存期間(PFS)、奏効期間(DOR)、奏効に至るまでの期間のサブグループ解析を行った。
有効性及び安全性について、フォローアップ(最小追跡期間64ヵ月)解析を行なった。
1) 小野薬品工業:国際共同第Ⅲ相(ONO-4538-03/CA209025)試験成績(社内資料)承認時評価資料
2) Motzer RJ, et al. N Engl J Med. 373(19): 1803-1813, 2015
[ 利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の資金提供を受けて実施された。
3) Cella D, et al. Lancet Oncol. 17(7): 994-1003, 2016
[ 利益相反]本試験は、Bristol-Myers Squibbの資金提供を受けて実施された。
患者背景
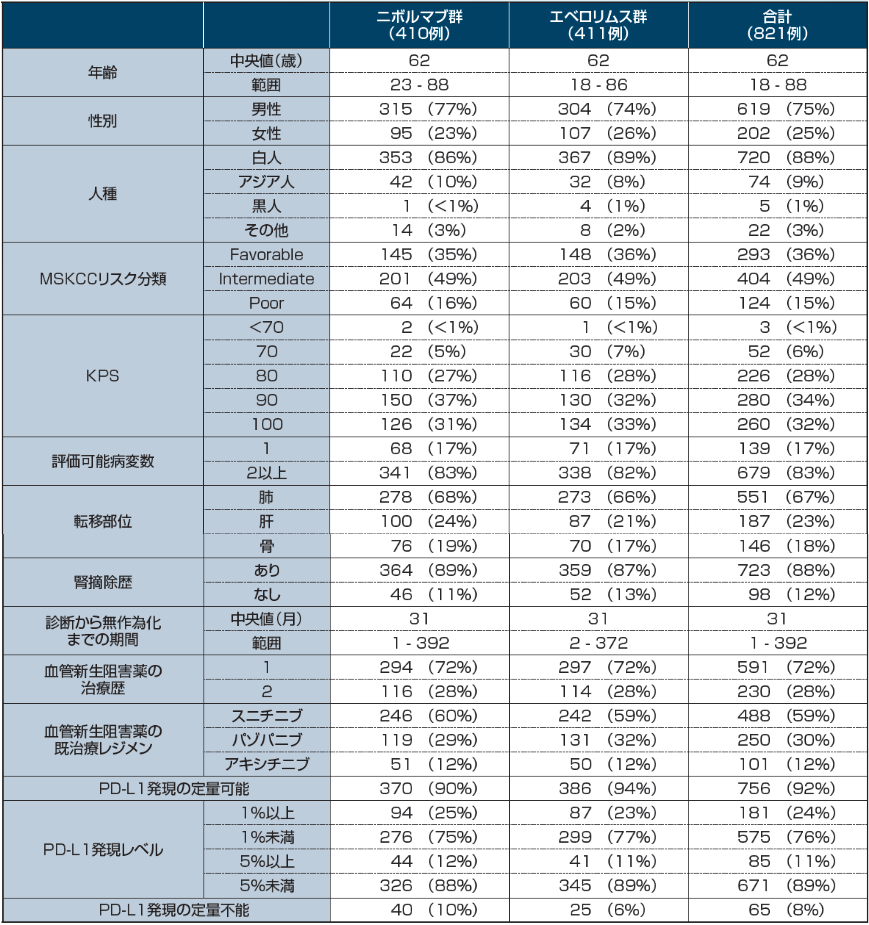
Copyright © 2015 Massachusetts Medical Society. All rights reserved. Translated with permission.
Motzer RJ, et al. N Engl J Med. 373(19): 1803-1813, 2015
有効性
全生存期間(OS)[主要評価項目]
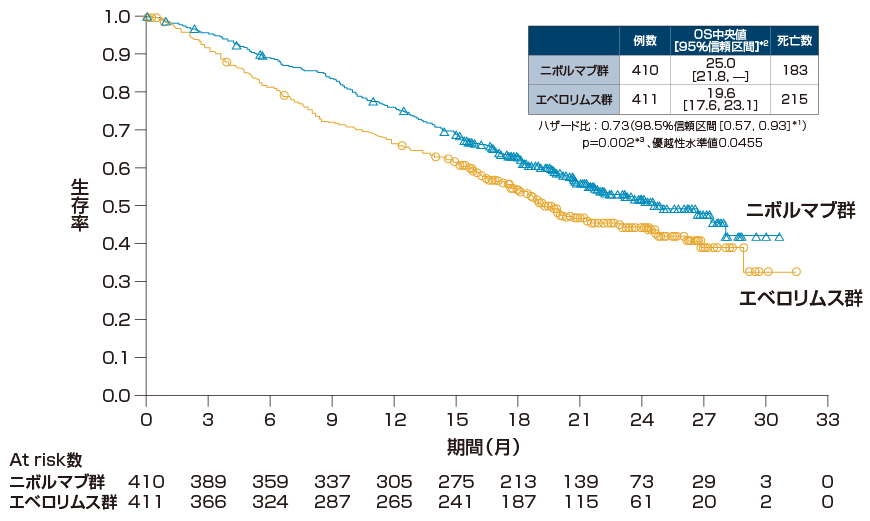
・検証的解析結果
全生存期間(OS)について、エベロリムス群に対するオプジーボ群のハザード比は0.73(98.5%信頼区間[0.57, 0.93]*1、p=0.002、層別log-rank検定、優越性水準値0.0455)であり、オプジーボ群のエベロリムス群に対する優越性が検証されました。
OSの中央値は、オプジーボ群で25.0ヵ月(95%信頼区間[21.8, ー]*2)、エベロリムス群で19.6ヵ月(95%信頼区間[17.6,23.1]*2)でした。
*1 層別Cox比例ハザードモデル
*2 Brookmeyer-Crowley法
*3 層別log-rank検定
層別因子:地域、MSKCCリスク分類、血管新生阻害薬の治療レジメン数
最小追跡期間:14ヵ月
Copyright © 2015 Massachusetts Medical Society. All rights reserved. Translated with permission.
Motzer RJ, et al. N Engl J Med. 373(19): 1803-1813, 2015
小野薬品工業:国際共同第Ⅲ相(ONO-4538-03/CA209025)試験成績(社内資料)承認時評価資料
全生存期間(OS)[主要評価項目]
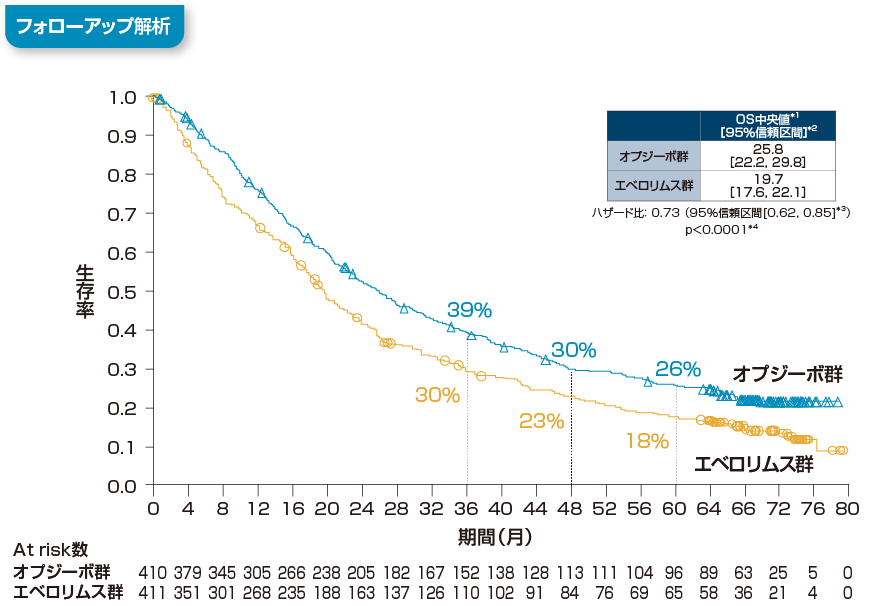
全生存期間(OS)について、長期フォローアップ時点(最小追跡期間64ヵ月)における中央値は、オプジーボ群で25.8ヵ月(95%信頼区間[22.2, 29.8]*2)、エベロリムス群で19.7ヵ月(95%信頼区間[17.6, 22.1]*2)でした。エベロリムス群に対するオプジーボ群のハザード比は0.73(95%信頼区間[0.62, 0.85]*3、p<0.0001、層別log-rank検定)であり、オプジーボ群のエベロリムス群に対するOSの有意な延長が認められました。また、60ヵ月時点のランドマークポイントにおける生存率*1は、オプジーボ群で26%、エベロリムス群で18%でした。
*1 Kaplan-Meier法
*2 Brookmeyer-Crowley法
*3 層別Cox比例ハザードモデル
*4 層別log-rank検定
層別因子:地域、MSKCCリスク分類、血管新生阻害薬の治療レジメン数
最小追跡期間:64ヵ月 Motzer RJ, et al. Cancer. 2020; 126(18): 4156-4167.より作成
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
無増悪生存期間(PFS)[副次的評価項目]
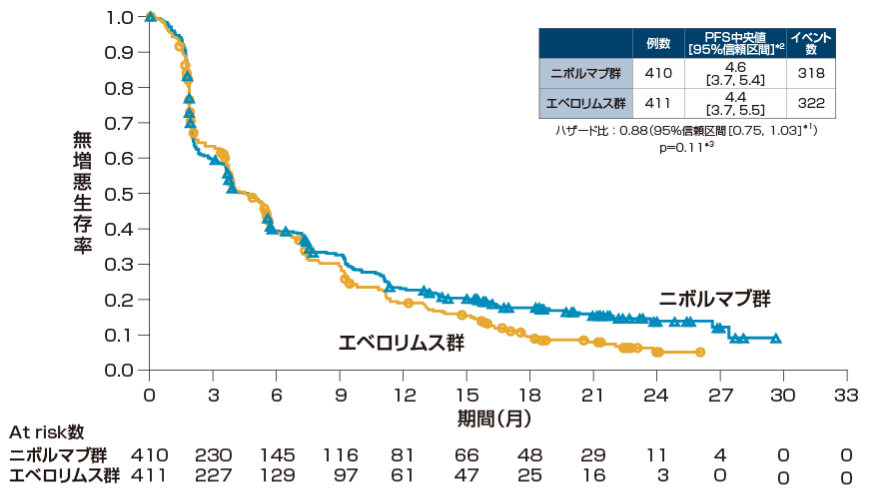
無増悪生存期間(PFS)の中央値は、オプジーボ群で4.6ヵ月(95%信頼区間[3.7, 5.4]*2)、エベロリムス群で4.4ヵ月(95%信頼区間[3.7, 5.5]*2)であり、両群間に統計学的有意差を認めませんでした(層別log-rank検定)。
*1 層別Cox比例ハザードモデル
*2 Brookmeyer-Crowley法
*3 層別log-rank検定
層別因子:地域、MSKCCリスク分類、血管新生阻害薬の治療レジメン数
RECIST1.1版に基づく試験実施施設の医師判定
Copyright © 2015 Massachusetts Medical Society. All rights reserved. Translated with permission.
Motzer RJ, et al. N Engl J Med. 373(19): 1803-1813, 2015
小野薬品工業:国際共同第Ⅲ相(ONO-4538-03/CA209025)試験成績(社内資料)承認時評価資料
無増悪生存期間(PFS)[副次的評価項目]
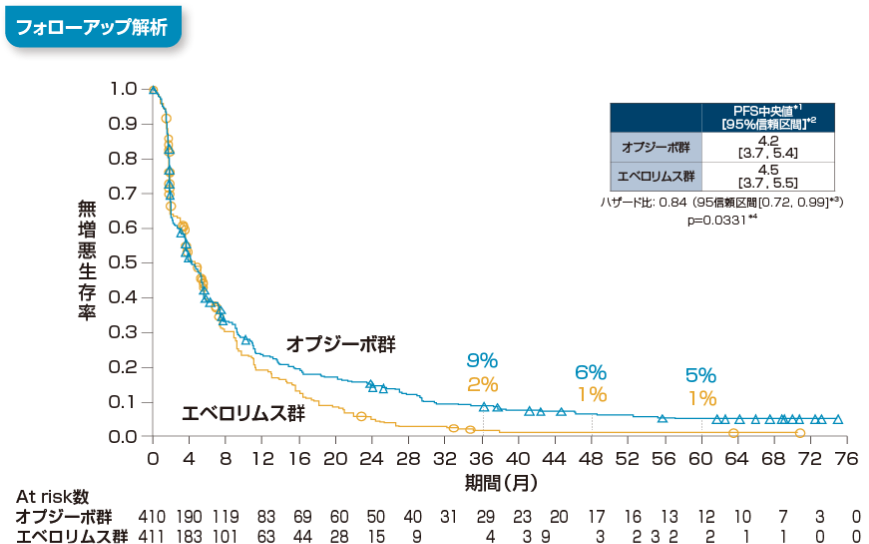
無増悪生存期間(PFS)について、長期フォローアップ時点(最小追跡期間64ヵ月)における中央値は、オプジーボ群で4.2ヵ月(95%信頼区間[3.7, 5.4]*2)、エベロリムス群で4.5ヵ月(95%信頼区間[3.7, 5.5]*2)でした。エベロリムス群に対するオプジーボ群のハザード比は0.84(95%信頼区間[0.72, 0.99]*3、p=0.0331、層別log-rank検定)でした。また、 60ヵ月時点のランドマークポイントにおける無増悪生存率*1は、オプジーボ群で5%、エベロリムス群で1%でした。
*1 Kaplan-Meier法
*2 Brookmeyer-Crowley法
*3 層別Cox比例ハザードモデル
*4 層別log-rank検定
層別因子:地域、MSKCCリスク分類、血管新生阻害薬の治療レジメン数
RECIST1.1版に基づく試験実施施設の医師判定
最小追跡期間:64ヵ月
Motzer RJ, et al. Cancer. 2020; 126(18): 4156-4167.より作成
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
奏効率(ORR)[副次的評価項目]
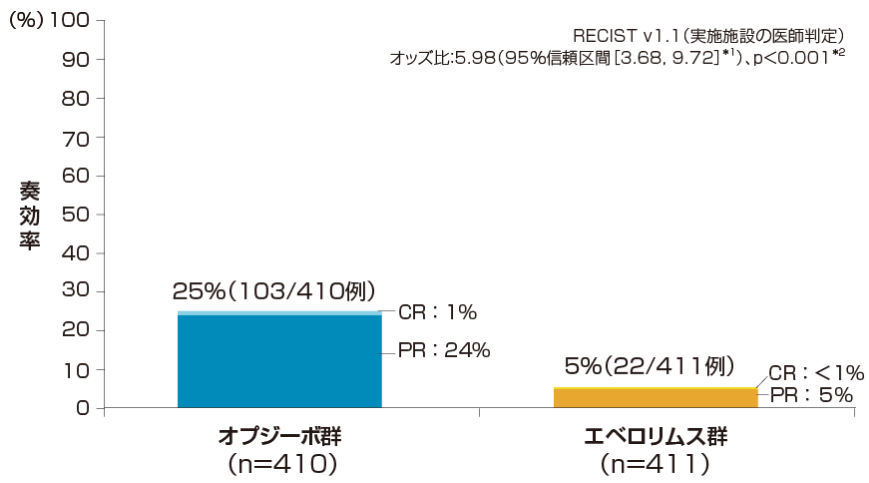
奏効率は、オプジーボ群で25%(CR 4例、PR 99例)、エベロリムス群で5%(CR 2例、PR 20例)でした。オッズ比は5.98(95%信頼区間[3.68, 9.72]*1)であり、オプジーボ群で有意に高い奏効率でした(p<0.001、層別Cochran-Mantel- Haenszel検定)。
*1 Clopper-Pearson法
*2 層別Cochran-Mantel-Haenszel検定
層別因子:地域、MSKCCリスク分類、
血管新生阻害薬の治療レジメン数
Motzer RJ, et al. N Engl J Med. 373(19): 1803-1813, 2015より作図
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
奏効期間(DOR)[副次的評価項目]
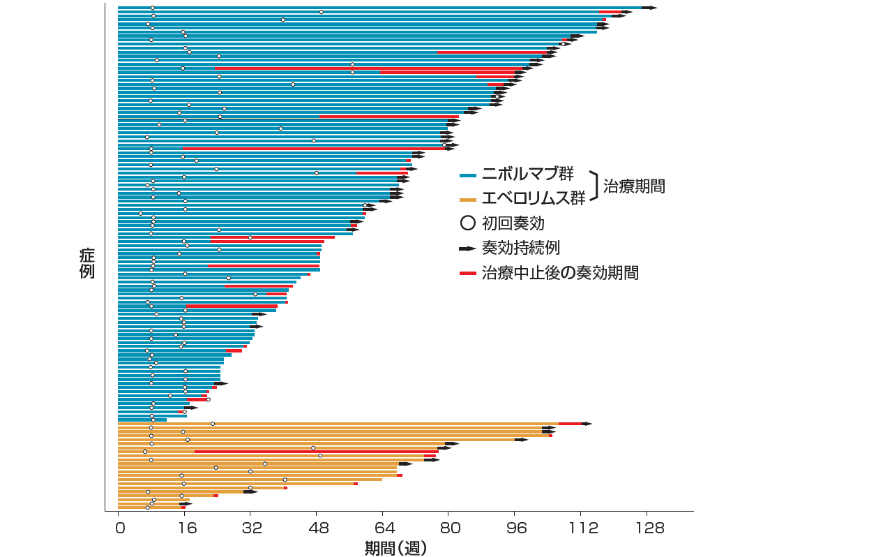
奏効が認められたオプジーボ群103例、エベロリムス群22例において、奏効期間(DOR)の中央値は、オプジーボ群で12.0ヵ月(95%信頼区間[7.9, 23.0]*)、エベロリムス群で12.0ヵ月(95%信頼区間[6.4, ー]*)でした。
12ヵ月以上の奏効は、オプジーボ群の32例に、エベロリムス群の6例に認められました。
* Brookmeyer-Crowley法
Copyright © 2015 Massachusetts Medical Society. All rights reserved. Translated with permission.
Motzer RJ, et al. N Engl J Med. 373(19): 1803-1813, 2015 Supplementary Appendix
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
奏効率(ORR)[副次的評価項目]
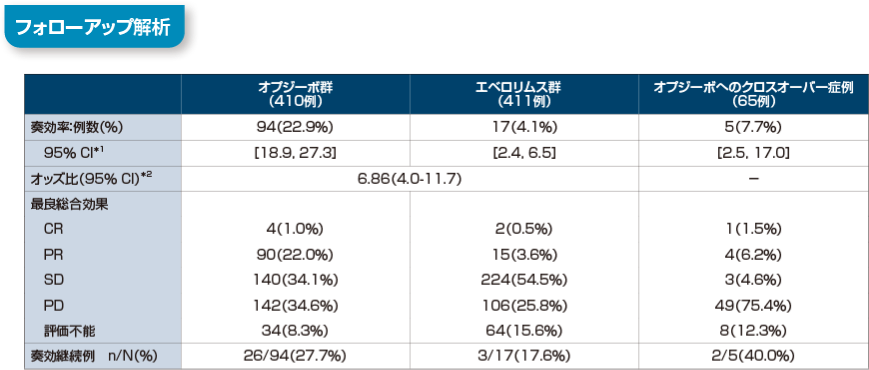
長期フォローアップ時点(最小追跡期間64ヵ月)における奏効率は、オプジーボ群で22.9%(95%信頼区間[18.9,27.3]*1) 、エベロリムス群で4.1%(95%信頼区間[2.4, 6.5]*1)でした。オッズ比は6.86(95%信頼区間[4.0,11.7]*2)でした。また、オプジーボへのクロスオーバー症例における奏効率は7.7%でした。奏効継続例は、オプジーボ群で27.7%(26/94例)、エベロリムス群で17.6%(3/17例)でした。
RECIST1.1版に基づく試験実施施設の医師判定
*1 Clopper-Pearson法
*2 層別Cochran-Mantel-Haenszel検定
最小追跡期間:64ヵ月
Motzer RJ, et al. Cancer. 2020; 126(18): 4156-4167.より作成
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
安全性
副作用発現状況
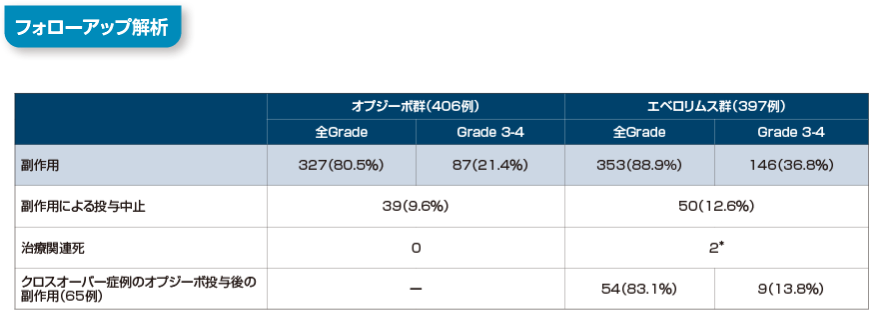
64ヵ月フォローアップ時点までに認められたオプジーボ群の主な副作用は、全グレードで、疲労141例(34.7%)、そう痒症63例(15.5%)、悪心61例(15.0%)、下痢56例(13.8%)であり、グレード3-4では疲労11例(2.7%)、貧血8例(2.0%)、アラニンアミノトランスフェラーゼ増加及びアスパラギン酸アミノトランスフェラーゼ増加各7例(1.7%)でした。
エベロリムス群の主な副作用は、全グレードで、疲労137例(34.5%)、口内炎117例(29.5%)、貧血97例(24.4%)であり、グレード3-4では貧血34例(8.6%)、高トリグリセリド血症18例(4.5%)、口内炎17例(4.3%)、高血糖15例(3.8%)でした。
投与中止に至った副作用はオプジーボ群で39例(9.6%)、エベロリムス群で50例(12.6%)でした。エベロリムス群においてオプジーボ投与にクロスオーバーした症例におけるオプジーボ投与後の副作用は全グレードで54例(83.1%)、グレード3-4では9例(13.8%)でした。
Motzer RJ, et al. Cancer. 2020; 126(18): 4156-4167.より作成
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
留意すべき副作用の発現までの期間および発現から回復までの期間
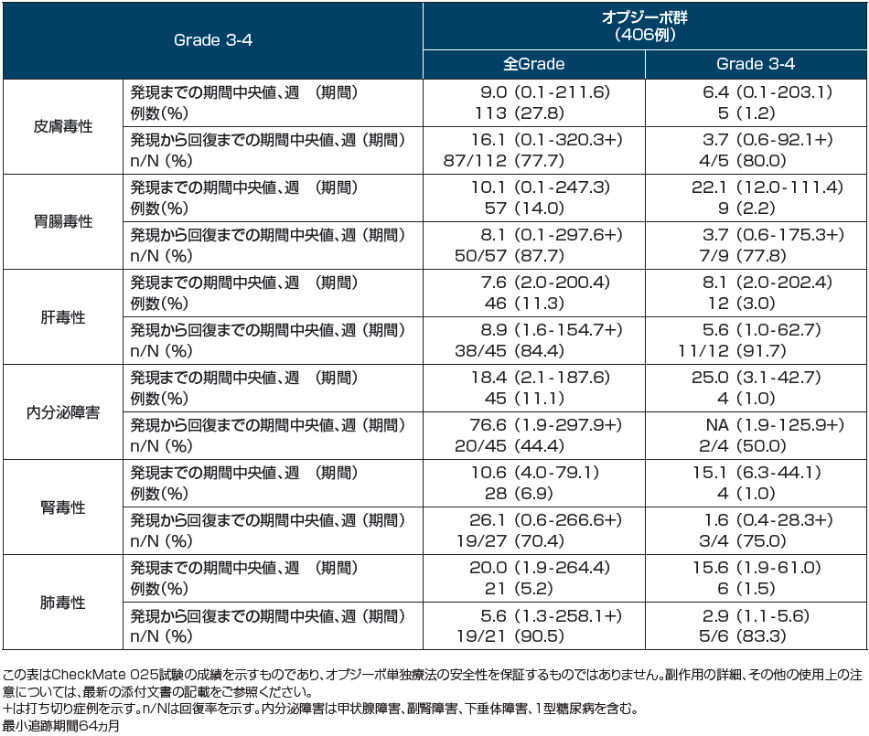
Motzer RJ, et al. Cancer. 2020; 126(18): 4156-4167.
Supporting Table 4より作成
[利益相反]本試験はBristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
その他
HRQoL:FKSI-DRSスコアへの影響[副次的評価項目、参考情報]
オプジーボ群におけるFKSI-DRSのQoLスコアは、以下に示す通りに推移しました。
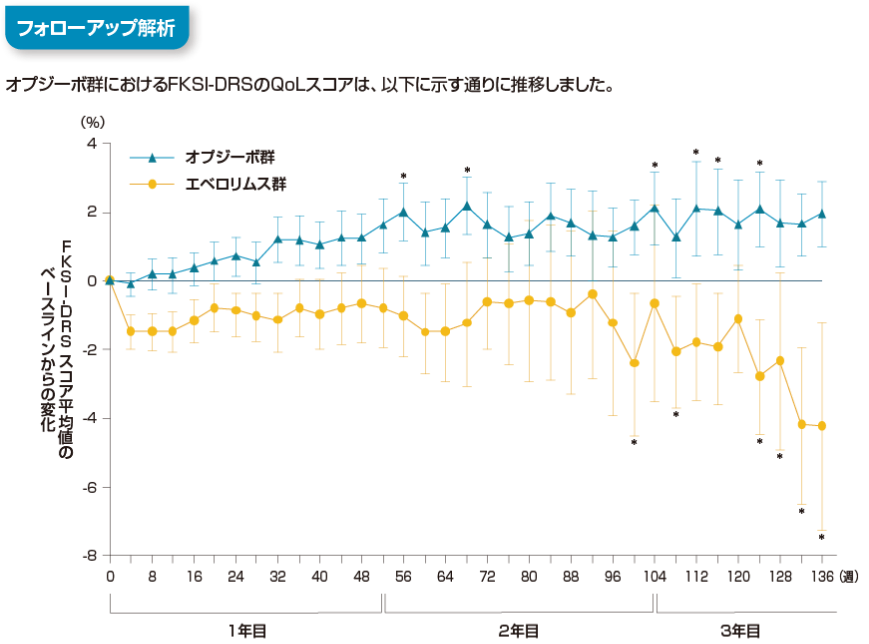
FKSI-DRS: Functional Assessment of Cancer Therapy Kidney Cancer Symptom Index-Disease Related Symptoms
FKSI-DRS : Functional Assessment of Cancer Therapy Kidney Cancer Symptom Index-Disease Related Symptoms
腎癌に特異的なQoL評価尺度で、腎癌関連症状に関する9項目(活力不足、疼痛、体重減少、骨痛、疲労、息切れ、咳嗽、発熱、血尿)の質問から構成される。各項目の合計で0〜36点の範囲をとり、点数が高いほど疾患関連症状がなく、HRQoLが良好な状態を示す。
Motzer RJ, et al. Cancer. 2020; 126(18): 4156-4167.より作成
[利益相反]本試験は、Bristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
国際共同第Ⅲ相試験(CheckMate 025) 日本人サブグループ解析
3年フォローアップ(追跡期間中央値40ヵ月)
日本人部分集団の患者背景は、全体集団と概ね近似していました。
ただし、Karnofsky PSスコア100の症例の割合は全体集団と比較して日本人部分集団で高く、また、日本人部分集団において、オプジーボ群はエベロリムス群と比較して転移臓器数2個以上、肝転移あり、PD-L1発現1%以上の症例が多くみられました。
患者背景
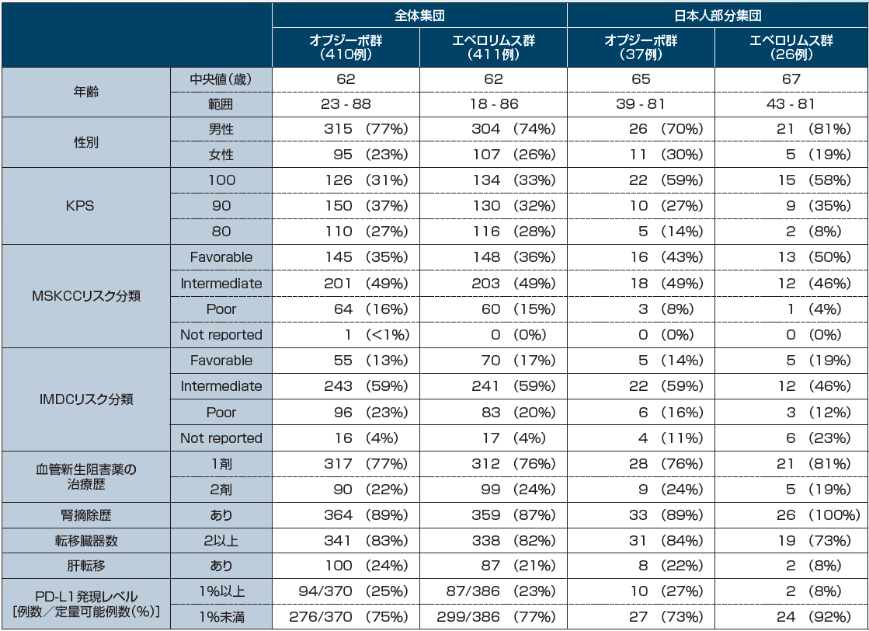
Tomita Y, et al. Jpn. J. Clin. Oncol. 2019; 49(6): 506-514.より改変
[利益相反]本試験はBristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
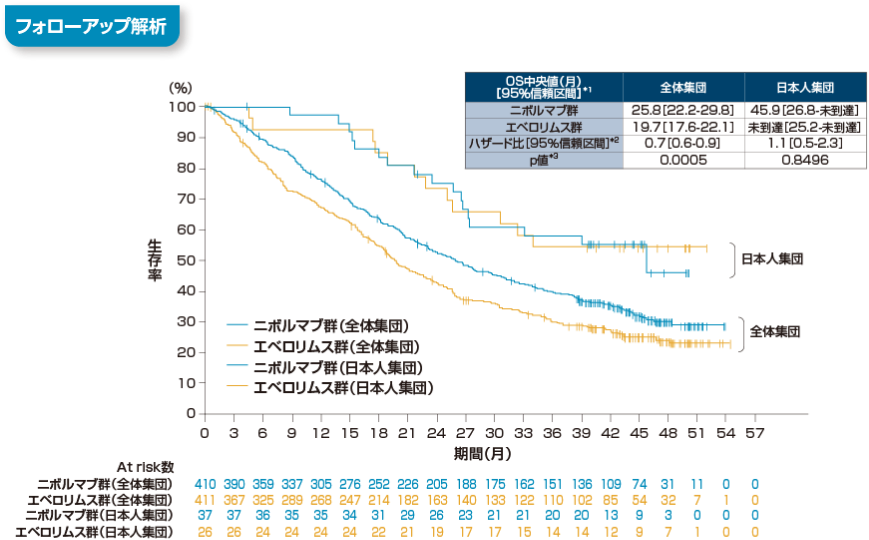
全生存期間(OS)[全体集団:主要評価項目, 日本人部分集団:サブグループ解析]
無増悪生存期間(PFS)[全体集団:副次的評価項目, 日本人部分集団:サブグループ解析]
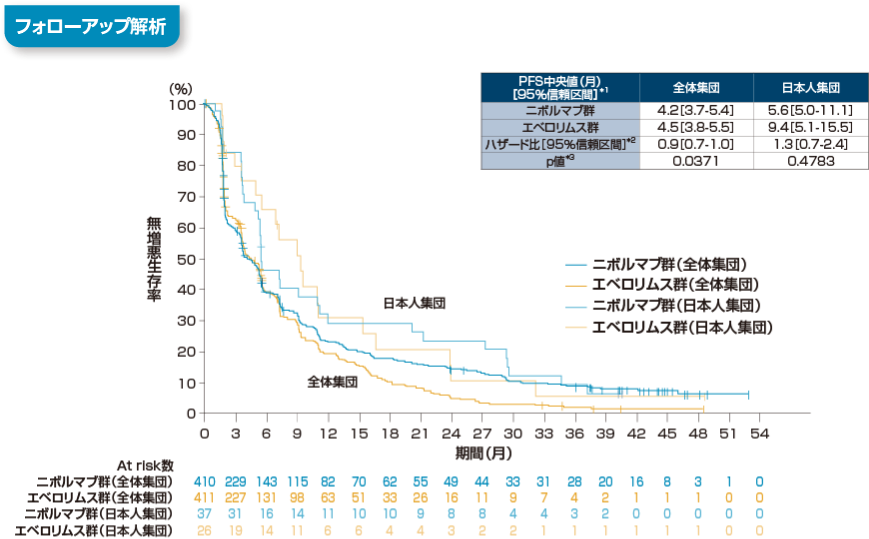
*1 Kaplan-Meier法
*2 層別Cox比例ハザードモデル
*3 層別log-rank検定、
層別因子:MSKCCリスク分類及び血管新生阻害剤の治療レジメン数
追跡期間中央値:40ヵ月
©2019 Japanese Journal of Clinical Oncology. All rights reserved. Yoshihiko Tomita, Satoshi Fukasawa, Nobuo Shinohara et al.
Nivolumab versus everolimus in advanced renal cell carcinoma: Japanese subgroup 3-year follow-up analysis from the Phase
III CheckMate 025 study.
Japanese Journal of Clinical Oncology 2019; 49(6): 506-514.
[利益相反]本試験はBristol-Myers Squibb及び小野薬品工業の支援を受けて実施された。
4. 効能又は効果(一部抜粋)
根治切除不能又は転移性の腎細胞癌
5. 効能又は効果に関連する注意(一部抜粋)
5.2 化学療法未治療の場合、IMDC注)リスク分類がintermediate又はpoorリスクの患者を対象とすること。 注):International Metastatic RCC Database Consortium
6. 用法及び用量(一部抜粋)
〈根治切除不能又は転移性の腎細胞癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
化学療法未治療の根治切除不能又は転移性の腎細胞癌に対してイピリムマブ(遺伝子組換え)と併用する場合は、通常、成人にはニボルマブ (遺伝子組換え)として、1回240mgを3週間間隔で4回点滴静注する。その後、ニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能又は転移性の腎細胞癌〉
7.2 化学療法未治療患者及びサイトカイン製剤のみの治療歴を有する患者に対する本剤単独投与の有効性及び安全性は確立していない。

















