CheckMate 214試験(国際共同第Ⅲ相試験)概要
本試験におけるオプジーボの用法及び用量は、現在承認されている用法及び用量と異なります。
本試験は、未治療の進行性又は転移性の淡明細胞型腎細胞癌を対象として、オプジーボとヤーボイ併用療法のスニチニブ単剤療法に対する優越性を検証するとともに、安全性も検討しました。
試験概要
試験デザイン

評価項目
主要評価項目:IMDC Intermediate/Poorリスク集団における、 全生存期間(OS)、奏効率(ORR)†、無増悪生存期間(PFS)†
副次的評価項目:全リスク集団におけるOS、ORR†、PFS†
探索的評価項目:Favorableリスク集団におけるOS、ORR†、PFS†、 PD-L1発現レベル別の評価(Intermediate/Poorリスク集団)、安全性(死亡、有害事象 等)、QOL(FKSI-19等)
その他の評価項目:奏効期間(DOR)及び奏効に至るまでの期間(TTR)(奏効例のみを解析)
【解析計画】
(一部抜粋)
主要評価項目の優越性の有意水準(両側)は全体で0.05として、OSに0.04、ORRに0.001、PFSに0.009を配分した。なお、O‘Brien-Fleming 型のα消費関数により、中間解析時点のOSの優越性水準値は0.002とした。
PFSの最終解析は、IMDC Intermediate/Poorリスク集団で465件のイベント観測後に実施し、OSの中間解析は330件(最終解析に必要な目標イベント数の52%)のイベント観測後に実施するとした。1、2及び3年時のOS及びその両側95%信頼区間を算出することとしていたが、実際の解析は最短の追跡期間に応じて実施した(12、18、24、30、42、48ヵ月時点)。
DORは初回の奏効から死亡又はPDが認められるまでの期間として、TTRは無作為化から初回の確定奏効が認められるまでの期間として、それぞれ奏効例のみ解析を実施した。
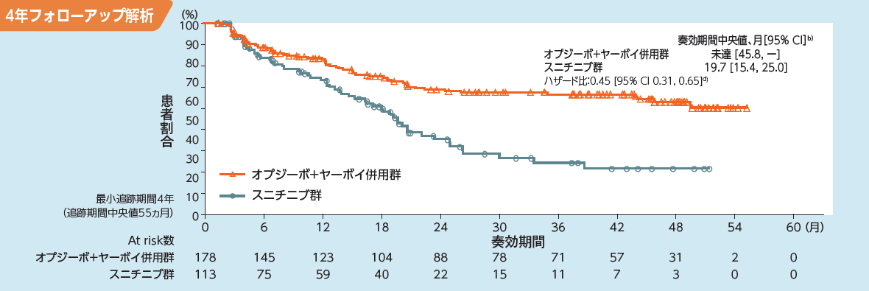
有効性及び安全性について、フォローアップ[最小追跡期間4年(追跡期間中央値55ヵ月)]解析を実施した。
OS、PFS、ORR について、年齢、性別、実施地域、ベースライン時のIMDC リスク分類、腎摘除術歴、ベースライン時のPD-L1 発現レベルなどを層別因子としてサブグループ解析を実施した。
*1:切除可能な腎細胞癌に対する1種類のアジュバント療法又はネオアジュバント療法(VEGF又はVEGFRを標的とした薬剤は除く)が施行され、かつ、その最終投与から6ヵ月以上経過後に再発した場合は許容する
*2:オプジーボ+ヤーボイ併用群では、投与開始から2年以上経過した症例について病勢進行又は許容できない毒性発現がなくとも投与を中止可能
†:RECIST1.1版、独立画像判定委員会(IRRC)の評価による
OPD:オプジーボ YV:ヤーボイ
※ 本邦における承認はintermediate/poorリスク患者
小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-16/CA209214)試験成績(社内資料)承認時評価資料より作成
有効性
全生存期間(OS)[主要評価項目](IMDC Intermediate/Poorリスク集団)
全生存期間(OS)[主要評価項目](IMDC Intermediate/Poorリスク集団)
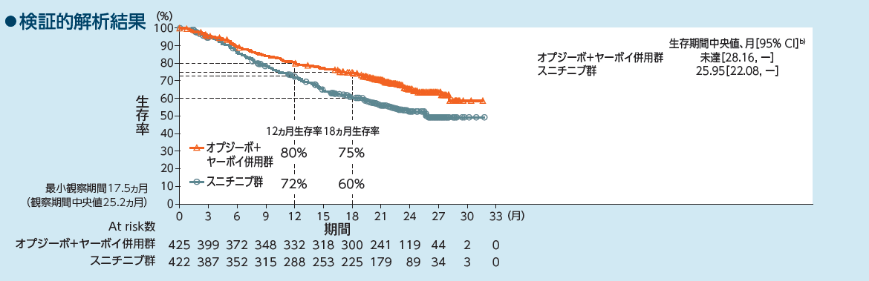
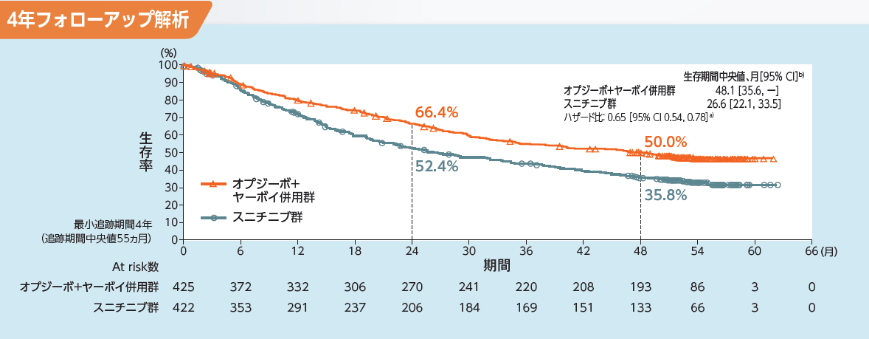
Intermediate/Poorリスク集団のOSについて、主解析時点におけるオプジーボ+ヤーボイ併用群のスニチニブ群に対するハザード比は0.63 (99.8%信頼区間[0.44, 0.89]a))、p<0.0001(優越性水準値0.002、層別log-rank検定)であり、オプジーボ+ヤーボイ併用群のスニチニブ群に対する優越性が検証されました。OS中央値は、オプジーボ+ヤーボイ併用群で未達(95%信頼区間[28.16, -]b))、スニチニブ群で25.95ヵ月(95%信頼区間[22.08, -]b))でした。12ヵ月時点及び18ヵ月時点の生存率は、オプジーボ+ヤーボイ併用群でそれぞれ80% (95%信頼区間[76, 84]b))、75% (95%信頼区間[70, 78]b))、スニチニブ群でそれぞれ72% (95%信頼区間[67, 76]b))、60% (95%信頼区間[55, 65]b))でした1,2)。Intermediate/Poorリスク集団のOSについて、長期フォローアップ時点[最小追跡期間4年(追跡期間中央値55ヵ月)]における中央値は、オプジーボ+ヤーボイ併用群で48.1ヵ月(95%信頼区間[35.6,NE]b))、スニチニブ群で26.6ヵ月(95%信頼区間[22.1, 33.5]b))でした。また、オプジーボ+ヤーボイ併用群のスニチニブ群に対するハザード比は0.65(95%信頼区間[0.54, 0.78]a))であり、24ヵ月時点のランドマークポイントにおける生存率b)は、オプジーボ+ヤーボイ併用群で66.4%、スニチニブ群で52.4%であり、48ヵ月時点はそれぞれ50.0%、35.8%でした3)。
a) 層別Cox比例ハザードモデル、b) Kaplan-Meier法、層別因子:IMDCリスク分類及び地域
1)小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-16/CA209214)試験成績(社内資料)承認時評価資料
2)Motzer RJ, et al. N Engl J Med. 2018; 378(14) : 1277-1290.
3)Albiges L, et al. ESMO Open. 2020; 5(6):e001079.
[利益相反]本試験はBristol-Myers Squibbと小野薬品工業の支援を受けて実施された。
a) 層別Cox比例ハザードモデル、b) Kaplan-Meier法、層別因子:IMDCリスク分類及び地域
1)小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-16/CA209214)試験成績(社内資料)承認時評価資料
2)Motzer RJ, et al. N Engl J Med. 2018; 378(14) : 1277-1290.
3)Albiges L, et al. ESMO Open. 2020; 5(6):e001079.
[利益相反]本試験はBristol-Myers Squibbと小野薬品工業の支援を受けて実施された。
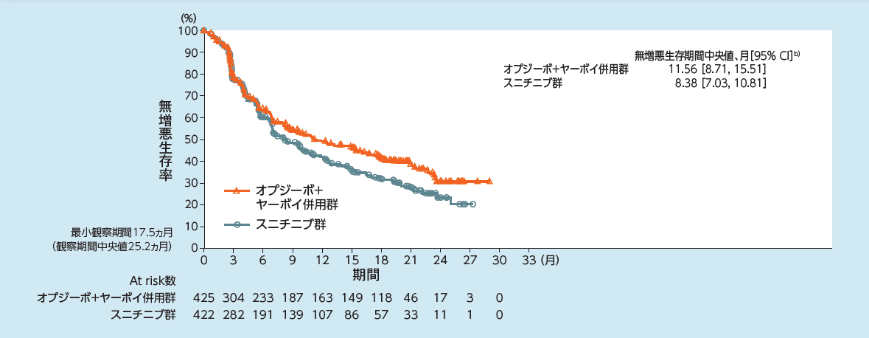
無増悪生存期間(PFS)[主要評価項目](IMDC Intermediate/Poorリスク集団、IRRC判定)
RECIST 1.1、IRRC判定
RECIST 1.1、IRRC判定
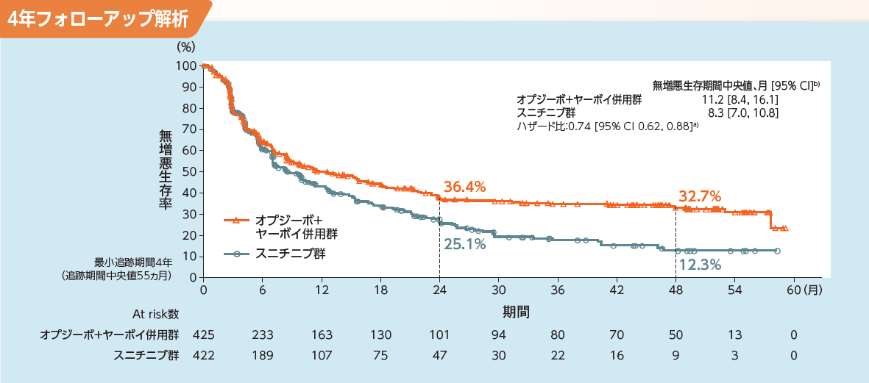
Intermediate/Poorリスク集団のPFSについて、主解析時点におけるオプジーボ+ヤーボイ併用群のスニチニブ群に対するハザード比は0.82 (99.1%信頼区間[0.64, 1.05]a))で あり、両群に有意な差は認められませんでした1,2)。長期フォローアップ時点[最小追跡期間4年(追跡期間中央値55ヵ月)]における中央値は、オプジーボ+ヤーボイ併用群で11.2ヵ月(95%信頼区間[8.4,16.1]b))、スニチニブ群で8.3ヵ月(95%信頼区間[7.0, 10.8]b))でした。また、オプジーボ+ヤーボイ併用群のスニチニブ群に対するハザード比は0.74(95%信頼区間[0.62, 0.88]b))でした3)。オプジーボ+ヤーボイ併用群のKaplan-Meier曲線からは、30%超の症例でPlateau到達が認められました3)。抗腫瘍効果は独立画像判定委員会(IRRC)が、RECIST1.1版に従い判定しました。
a) 層別Cox比例ハザードモデル、b) Kaplan-Meier法、層別因子:IMDCリスク分類及び地域
1)小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-16/CA209214)試験成績(社内資料)承認時評価資料
2)Motzer RJ, et al. N Engl J Med. 2018; 378(14) : 1277-1290.
3)Albiges L, et al. ESMO Open. 2020; 5(6):e001079.
[利益相反]本試験はBristol-Myers Squibbと小野薬品工業の支援を受けて実施された。
奏効率(ORR)[主要評価項目](IMDC Intermediate/Poorリスク集団、IRRC判定)
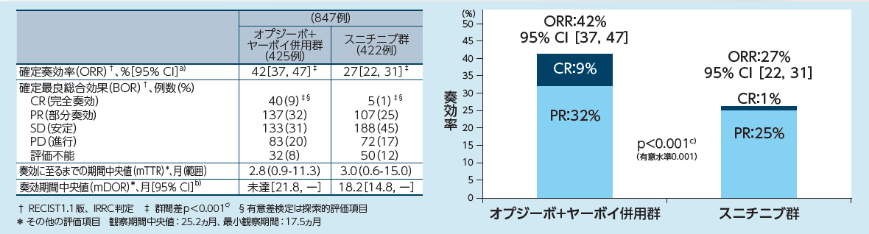
奏効期間(DOR)[その他の評価項目](IMDC Intermediate/Poorリスク集団、IRRC判定)
主解析時点※2におけるIntermediate/Poorリスク集団の奏効率(ORR)は、オプジーボ+ヤーボイ併用群で41.6%(177/425例、95%信頼区間[36.9,
46.5]a))、スニチニブ群で26.5%(112/422例、95%信頼区間[22.4,
31.0]a))であり、両群の95%信頼区間は重なりませんでした。完全奏効(CR)及び部分奏効(PR)はそれぞれの群で40例(9.4% )と5例(1.2% )及び137例(32.2%
)と107例(25.4% )でした1,2)
。また、オプジーボ+ヤーボイ併用群では奏効期間が中央値未達、スニチニブ群では18.17ヵ月でした。奏効が認められた症例のうち、奏効が持続していた割合はオプジーボ+ヤーボイ併用群が72%、スニチニブ群が63%でした。
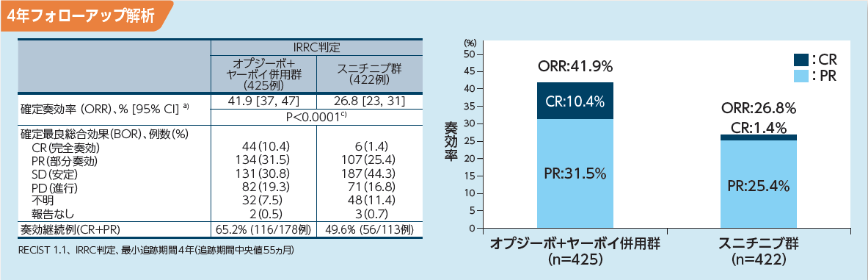
長期フォローアップ時点[最小追跡期間4年(追跡期間中央値55ヵ月)]における奏効率(ORR)はオプジーボ+ヤーボイ併用群で41.9% (178/425例、95%信頼区間[37.1,
46.7]a))、スニチニブ群で26.8% (113/422例、95%信頼区間[22.6,
31.3]a))であり、両群の95%信頼区間は重なりませんでした。CR及びPRはそれぞれの群で44例(10.4% )と6例(1.4% )及び134例(31.5% )と107例(25.4%
)であり、オプジーボ+ヤーボイ併用群の奏効例では65.2%(116/178例)が、スニチニブ群では49.6%(56/113例)が、それぞれ奏効を継続していました3)。また、奏効期間(DOR)中央値はオプジーボ+ヤーボイ併用群が未達(178例、95%信頼区間[45.8,
―]b))、スニチニブ群が19.7ヵ月(113例、95%信頼区間[15.4, 25.0]b))、ハザード比は0.45(95%信頼区間[0.31,
0.65]d))でした3)。
※2:追跡期間中央値25.2ヵ月、最小追跡期間17.5ヵ月
a)Clopper-Pearson法、b)Kaplan-Meier法、c)DerSimonian-Laird法、d)層別Cox比例ハザードモデル、e)
層別log-rank検定、層別因子:IMDCリスク分類及び地域
1)小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-16/CA209214)試験成績(社内資料)承認時評価資料
2)Motzer RJ, et al. N Engl J Med. 2018; 378(14) : 1277-1290.
3)Albiges L, et al. ESMO Open. 2020; 5(6):e001079.
[利益相反]本試験はBristol-Myers Squibbと小野薬品工業の支援を受けて実施された。
安全性
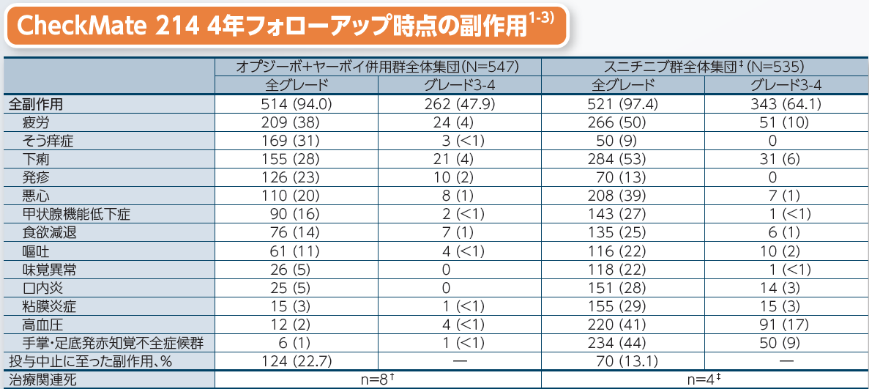
副作用の発現頻度は、治験薬の初回投与から最終投与後30日までに発現・増悪した副作用を対象として集計しました。フォローアップ時点のオプジーボ+ヤーボイ併用群における副作用は、全グレードで94%(514/547例)、グレード3-4で47.9%(262/547例)に発現が認められ、投与中止に至った副作用は22.7%(124/547例)でした。また、発現率の高かった(5例以上)投与中止に至った副作用(42ヵ月フォローアップ解析時点)は、ALT増加2.7%(15例)、肺臓炎及び下痢が各2.6%(14例)、AST増加2.2%(12例)、大腸炎及び下垂体炎が各1.3%(7例)、副腎不全0.1%(5例)でした4)。留意すべき副作用(全グレード)に対する高用量ステロイド*の使用は29.1%(159/547例)が報告されました。
†:オプジーボ+ヤーボイ併用群における治療関連死1.5%(8例)は肺臓炎、肺炎と再生不良性貧血、免疫介在性気管支炎、下部消化管出血、血球貪食症候群、突然死、薬剤性肝毒性及び肺感染が各0.2%(1例)で
した。
‡:スニチニブ群における治療関連死0.7%(4例)は心停止0.4%(2例)、右心不全及び多臓器不全が各0.2%(1例)でした。
*:40mg/日以上のプレドニゾン(本邦未承認)又は等価量のコルチコステロイド
留意すべき副作用は、免疫介在性の可能性があり、頻回なモニタリングと介入を必要とする副作用です。
1)小野薬品工業 / ブリストル・マイヤーズ スクイブ:国際共同第Ⅲ相(ONO-4538-16/CA209214)試験成績(社内資料)承認時評価資料
2)Motzer RJ, et al. N Engl J Med. 2018; 378(14) : 1277-1290
3)Albiges L, et al. ESMO Open. 2020; 5(6):e001079.
4) Motzer RJ, et al. J Immunother Cancer. 2020; 8(2):e000891. doi: 10.1136/jitc-2020-000891.
[利益相反]本試験はBristol-Myers Squibbと小野薬品工業の支援を受けて実施された。
その他
健康関連QOLへの影響[探索的評価項目]〔参考情報〕
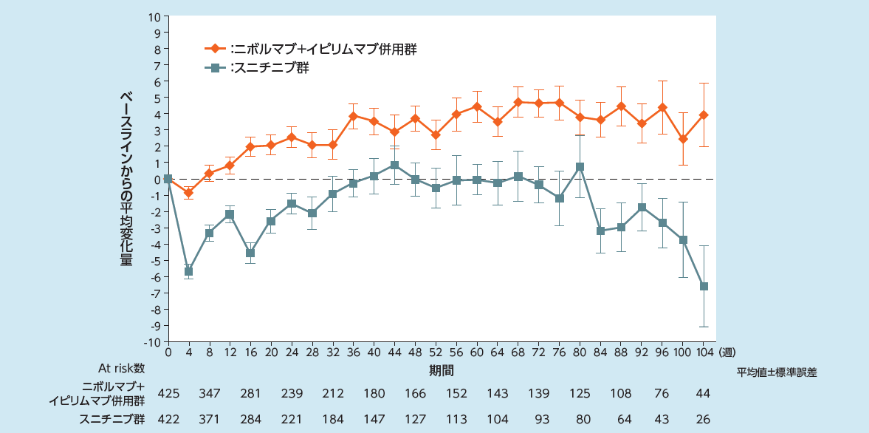
平均変化量がプラスの値をとるとき、健康関連QOLの指標となるFKSI-19のスコアがベースライン時より改善したことを示します。
FKSI-19: Functional Assessment of Cancer Therapy-Kidney Symptom Index 19
Copyright © 2018 Massachusetts Medical Society. All rights rese rved. Translated with
permission.
Motzer RJ, et al. N Engl J Med. 2018; 378(14): 1277-1290.
[利益相反]本試験はBristol-Myers Squibbと小野薬品工業の支援を受けて実施された。
4. 効能又は効果(一部抜粋)
根治切除不能又は転移性の腎細胞癌
5. 効能又は効果に関連する注意(一部抜粋)
5.2 化学療法未治療の場合、IMDC注)リスク分類がintermediate又はpoorリスクの患者を対象とすること。
注):International Metastatic RCC Database Consortium
6. 用法及び用量(一部抜粋)
〈根治切除不能又は転移性の腎細胞癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
化学療法未治療の根治切除不能又は転移性の腎細胞癌に対してイピリムマブ(遺伝子組換え)と併用する場合は、通常、成人にはニボルマブ(遺伝子
組換え)として、1回240mgを3週間間隔で4回点滴静注する。その後、ニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4
週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能又は転移性の腎細胞癌〉
7.2 化学療法未治療患者及びサイトカイン製剤のみの治療歴を有する患者に対する本剤単独投与の有効性及び安全性は確立していない。

















