CheckMate 9ER試験(国際共同第Ⅲ相試験)概要
CheckMate 9ER試験(国際共同第Ⅲ相試験)概
要
国際共同第Ⅲ相試験:ONO-4538-81/CheckMate 9ER試験
国際共同第Ⅲ相試験:ONO-4538-81/CheckMate 9ER試験
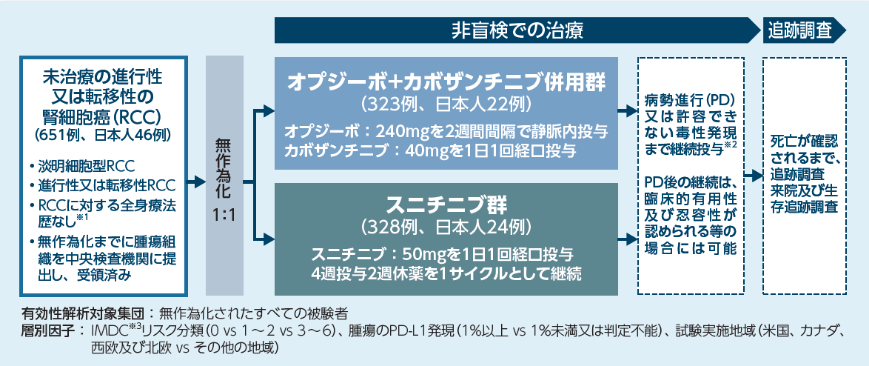
本試験は、未治療の進行性又は転移性の淡明細胞型腎細胞癌を対象として、オプジーボとカボザンチニブ併用投与のスニチニブ単剤投与に対する優越性を検証するとともに、安全性も検討しました。
試験概要
試験デザイン
【評価項目】
主要評価項目:無増悪生存期間(PFS)※4
副次的評価項目:全生存期間(OS)、奏効率(ORR)※4、安全性
その他の評価項目:奏効期間※4、奏効に至るまでの期間※4、健康関連QoL等
※1:切除可能な腎細胞癌に対する1種類の術前又は術後補助療法(VEGF又はVEGFRを標的とした薬剤は除く)が施行され、かつ、そ の最終投与から6 ヵ月以上経過後に再発した場合は許容する※2:オプジーボは、PD又は許容できない毒性発現がなくても、最 長投与期間を2年間とした。カボザンチニブ及びスニチニブ投与は、PD又は許容できない毒性発現がない場合、2年間を超えても良い
※3:International Metastatic RCC Database Consortium
※4:盲検下独立中央審査(BICR)判定(RECISTガイドライン1.1版に従う)
【解析計画】
(一部抜粋)
主要評価項目のPFS※4は、無作為化されたすべての被験者について、IMDCリスク分類、腫瘍のPD-L1発現及び地域を層別因子とした層別log-rank検定(両側有意水準:0.05)により投与群間で比較した。PFSの中央値はKaplan-Meier法を用いて推定し、その両側95%信頼区間(CI)は二重対数変換法を用いて算出した。ハザード比及びその両側95%CIは層別Cox比例ハザードモデルを用いて推定した。6ヵ月及び9ヵ月時点の無増悪生存率及びその両側95%CIを二重対数変換法を用いて算出した。OSの解析は、階層的検定手順に従って、PFSの最終解析で統計学的有意差が得られた場合に実施することとした。OSの1回目の中間解析は、PFSの最終解析時点で行った。OSの2回目の中間解析及び最終解析は、最初の被験者の、最初の来院からそれぞれ約34ヵ月後及び40ヵ月後に予定した。OSについて、PFSと同様の解析を実施した。OSの各解析における名目上の有意水準(両側)は、O’Brien-Fleming型のα消費関数を用いて実際の死亡数に基づき算出した。6ヵ月及び9ヵ月時点の生存率及びその両側95%CIを二重対数変換法を用いて算出した。最良総合効果※4は、投与群ごとにCR、PR、SD、PD及び判定不能の例数及びその割合を算出した。ORR※4は無作為化された被験者のうち、CR又はPRを達成した被験者の割合とした。ORRの検証的な解析は、階層的検定手順に従って、OSの解析(中間又は最終のいずれか早い方)で統計学的有意差が得られた場合に実施することとして、PFSの最終解析の時点で行った。各投与群のORR及びClopper-Pearson法によるその正確な95%CIを算出した。奏効期間※4は、投与群ごとにKaplan-Meier法により分布を推定し、中央値及びその両側95%CIは二重対数変換法を用いて算出した。奏効に至るまでの期間※4は、投与群ごとに記述統計量を算出した。健康関連QoLは、FKSI-19により、治験薬投与後の各評価時点のスコア及びベースラインからの変化量の記述統計量を要約した。
小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料より作成
患者背景
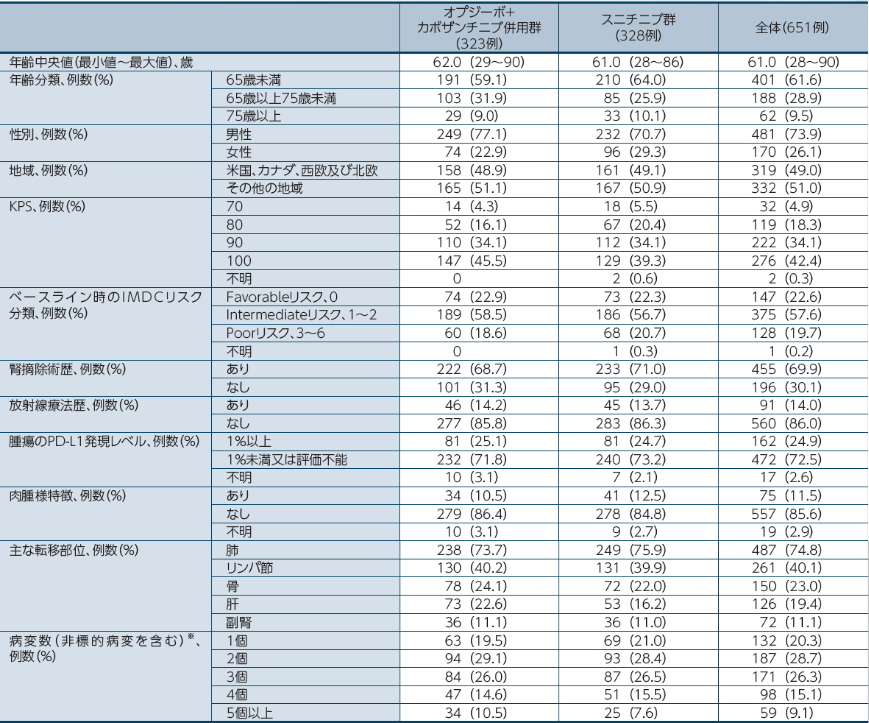

※: 17例の被験者(オプジーボ+カボザンチニブ併用群8例、スニチニブ群9例)が2個の骨病変部位を有し、その17例すべてが3個以上の病変部位を有していた
投与方法
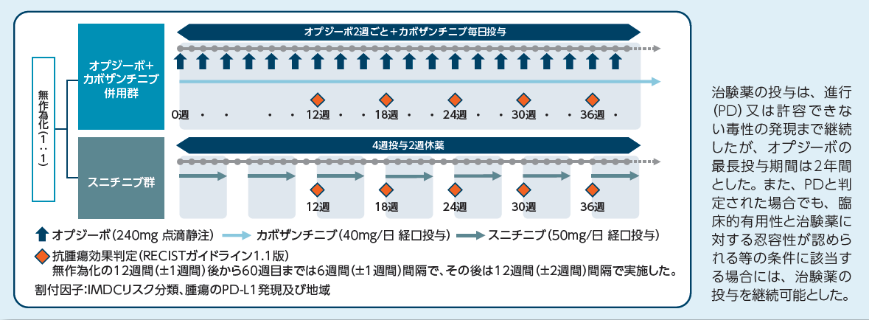
小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料より作成
有効性
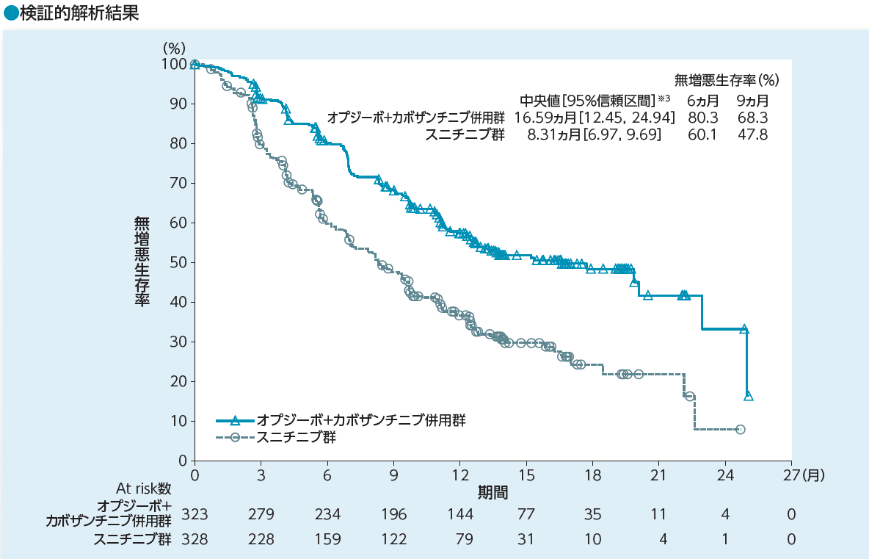
無増悪生存期間(PFS)[主要評価項目](BICR判定)
※1:
※2:
※3:Kaplan-Meier法
小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料
無増悪生存期間(PFS)中央値は、オプジーボ+カボザンチニブ併用群で16.59ヵ月(95%信頼区間[12.45, 24.94]※3)、スニチニブ群で8.31ヵ月(95%信頼区間[6.97,
9.69]※3)であり、オプジーボ+カボザンチニブ併用群のスニチニブ群に対する優越性が検証されました(p=0.0001両側:有意水準0.05、層別log-rank検定※2)。オプジーボ+カボザンチニブ併用群のスニチニブ群に対するハザード比は0.51(95%信頼区間[0.41,
0.64]※1)でした。
6ヵ月時点及び9ヵ月時点の無増悪生存率は、オプジーボ+カボザンチニブ併用群でそれぞれ80.3%、68.3%、スニチニブ群でそれぞれ60.1%、47.8%でした。
抗腫瘍効果は盲検下独立中央審査(BICR)によって、RECISTガイドライン1.1版に従い判定しました。
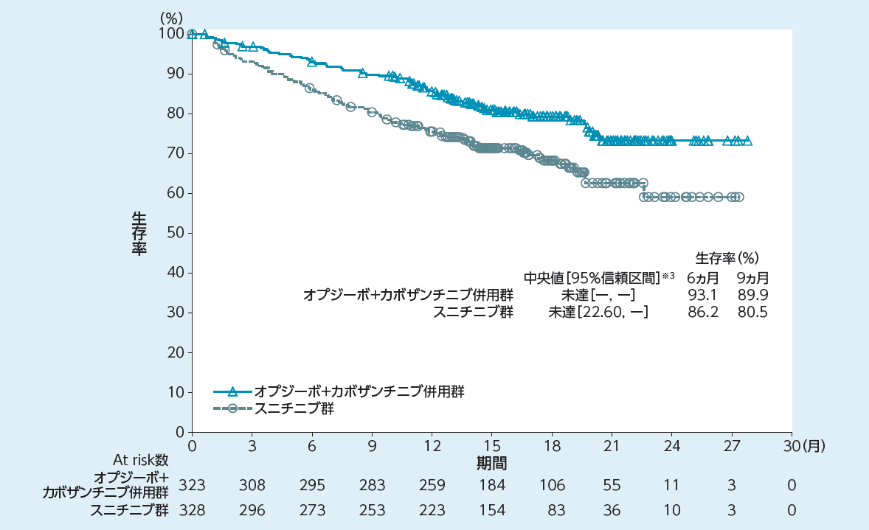
全生存期間(OS)[副次的評価項目]
※1:
※2:
※3:Kaplan-Meier法
小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料
全生存期間(OS)中央値はオプジーボ+カボザンチニブ併用群で未達(95%信頼区間[-, -]※3)、スニチニブ群で未達(95%信頼区間[22.60,
-]※3)であり、オプジーボ+カボザンチニブ併用群のスニチニブ群に対する有意な延長が認められました(p=0.0010両側:有意水準0.0111、層別log-rank検定※2)。
オプジーボ+カボザンチニブ併用群のスニチニブ群に対するハザード比は0.60(98.89%信頼区間[0.40,
0.89]※1)でした。6ヵ月時点及び9ヵ月時点の生存率は、オプジーボ+カボザンチニブ併用群でそれぞれ93.1%、89.9%、スニチニブ群でそれぞれ86.2%、80.5%でした。
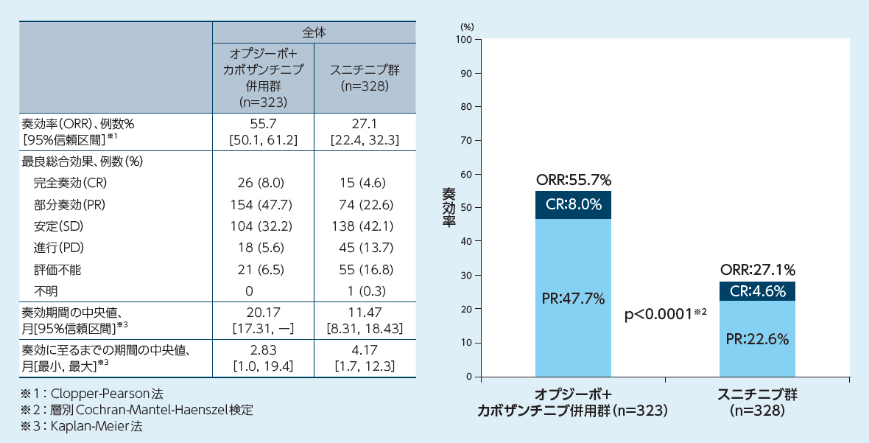
奏効率(ORR)[副次的評価項目](BICR判定)、奏効期間、奏効に至るまでの期間[その他の評価項目](BICR判定)
小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料より作成
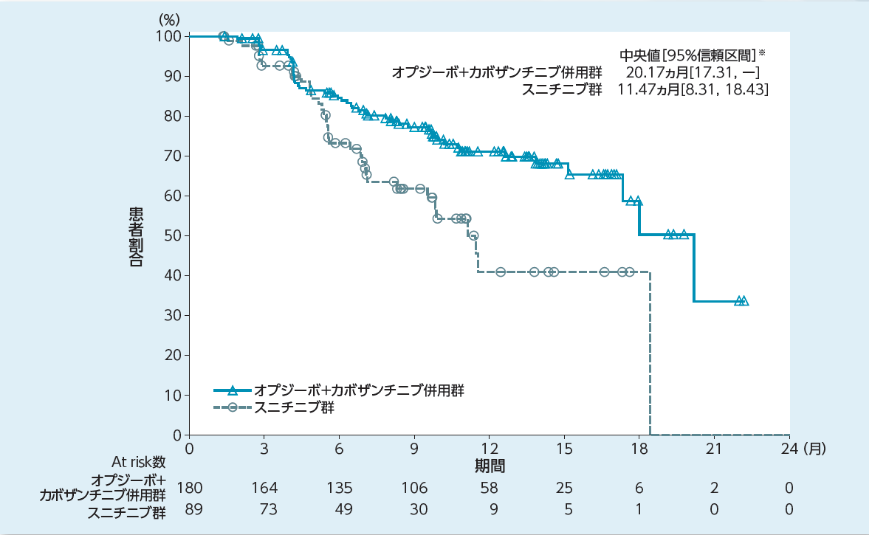
奏効期間[その他の評価項目](BICR判定)
※:Kaplan-Meier法
奏効率(ORR)はオプジーボ+カボザンチニブ併用群で55.7%(180/323例、95%信頼区間[50.1, 61.2]※1)、スニチニブ群で27.1%(89/328例、95%信頼区間[22.4,
32.3]※1)であり、オプジーボ+カボザンチニブ併用群で有意に高い奏効が認められました(p<0.0001※2)。
奏効期間の中央値はオプジーボ+カボザンチニブ併用群で20.17ヵ月※3、スニチニブ群で11.47ヵ月※3、奏効に至るまでの期間の中央値はオプジーボ+カボザンチニブ併用群で2.83ヵ月※3、スニチニブ群で4.17ヵ月※3でした。
抗腫瘍効果は盲検下独立中央審査(BICR)によって、RECISTガイドライン1.1版に従い判定しました。
安全性
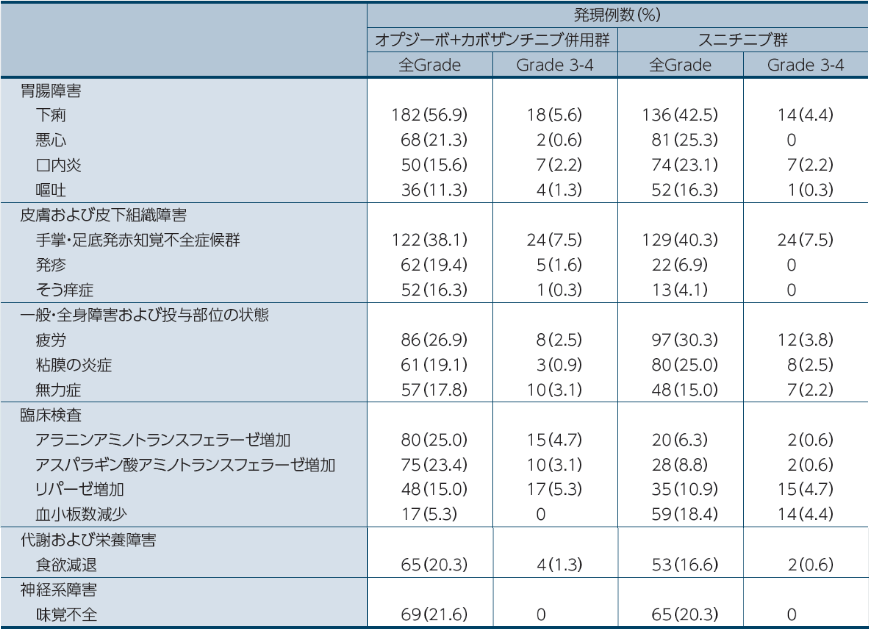
副作用はオプジーボ+カボザンチニブ併用群で96.6%(309/320例)、スニチニブ群で93.1%(298/320例)に認められました。主な副作用(15%以上)は、オプジーボ+カボザンチニブ併用群では、下痢56.9%(182例)、手掌・足底発赤知覚不全症候群38.1%(122例)、甲状腺機能低下症33.4%(107例)、高血圧30.3%(97例)、疲労26.9%(86例)、アラニンアミノトランスフェラーゼ増加25.0%(80例)、アスパラギン酸アミノトランスフェラーゼ増加23.4%(75例)、味覚不全21.6%(69例)、悪心21.3%(68例)、食欲減退20.3%(65例)、発疹19.4%(62例)、粘膜の炎症19.1%(61例)、無力症17.8%(57例)、そう痒症16.3%(52例)、口内炎15.6%(50例)、リパーゼ増加15.0%(48例)でした。スニチニブ群では、下痢42.5%(136例)、手掌・足底発赤知覚不全症候群40.3%(129例)、高血圧33.4%(107例)、疲労30.3%(97例)、甲状腺機能低下症28.1%(90例)、悪心25.3%(81例)、粘膜の炎症25.0%(80例)、口内炎23.1%(74例)、味覚不全20.3%(65例)、貧血19.1%(61例)、血小板減少症19.1%(61例)、血小板数減少18.4%(59例)、食欲減退16.6%(53例)、嘔吐16.3%(52例)、無力症15.0%(48例)でした。
重篤な副作用はオプジーボ+カボザンチニブ併用群24.4%(78例)、スニチニブ群12.8%(41例)に認められ、主なもの(2%以上)は、オプジーボ+カボザンチニブ併用群では下痢3.4%(11例)、肺臓炎2.8%(9例)でした。スニチニブ群では発現率が2%以上の重篤な副作用は認められず、最も発現率が高かったのは貧血1.6%(5例)でした。
投与中止に至った副作用はオプジーボ+カボザンチニブ併用群15.3%(49例)、スニチニブ群8.8%(28例)に認められました。いずれの群でも発現率が2%以上の投与中止に至った副作用は認められず、最も発現率が高かったものは、
オプジーボ+カボザンチニブ併用群ではアラニンアミノトランスフェラーゼ増加1.9%(6例)、スニチニブ群では蛋白尿1.9%(6例)でした。
死亡に至った副作用は、オプジーボ+カボザンチニブ併用群では0.3%(1例)[小腸穿孔]、スニチニブ群では0.6%(2例)[呼吸窮迫及び肺炎(各1例)]でした。
●いずれかの群で15%以上に発現した副作用一覧1)
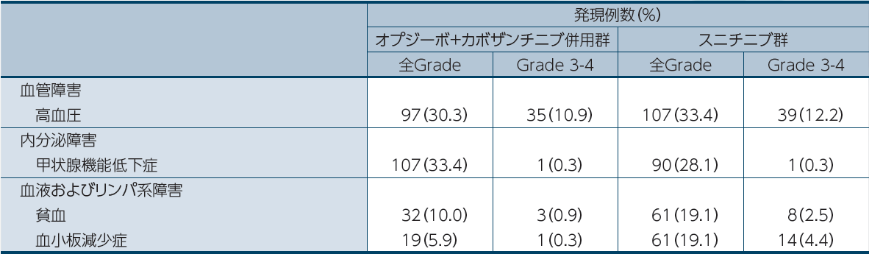
医師から報告された有害事象名は、CTCAE v4.0を用いて評価し、MedDRA
ver22.1Jを用いて読み替えた。因果関係は、「関連あり」、「関連なし」の2段階で評価され、「関連あり」と判定された場合に、副作用として集計した。なお、「不明」とされた場合も副作用として集計した。また、発現頻度は、最終投与後30日までに発現・増悪した副作用を対象として集計した。
オプジーボの投与に際して留意すべき免疫介在性有害事象(IMAE、5%以上)は、内分泌障害以外では肝炎10.0%(32例)、発疹10.0%(32例)、下痢/大腸炎5.3%(17例)、内分泌障害では甲状腺機能低下症/甲状腺炎25.3%(81例)、甲状腺機能亢進症9.4%(30例)でした1)。
IMAEの管理のため、オプジーボ+カボザンチニブ併用群の19.1%にステロイド(40mg/日以上のプレドニゾン[本邦未承認]又は等価量のコルチコステロイド)を使用しました。少なくとも14日間継続して使用した症例は10.3%、少なくとも30日間継続して使用した症例は3.8%でした2)。
●免疫介在性有害事象(IMAE)1)
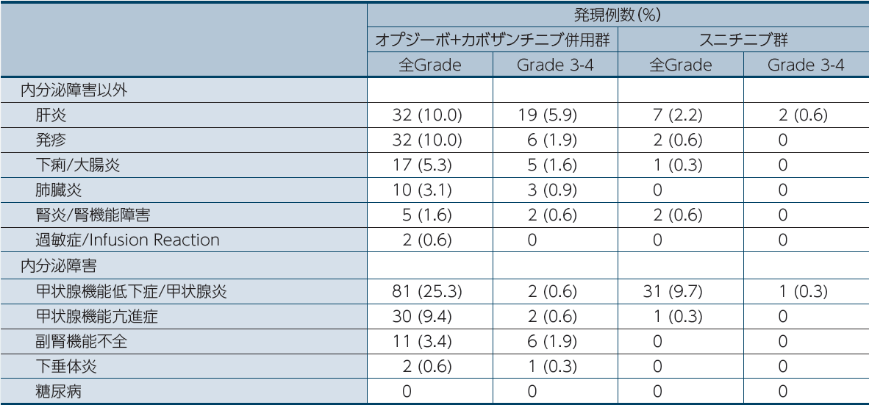
治験薬最終投与後100日以内に発現・増悪した事象を対象に集計した。
1) 小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料
2) Choueiri TK, et al. N Engl J Med. 2021: 384(9); 829-841.
[利益相反]本試験はBristol-Myers Squibbと小野薬品工業の支援を受けて実施された。
小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料より作成
その他
健康関連QoL[その他の評価項目]〔参考情報〕
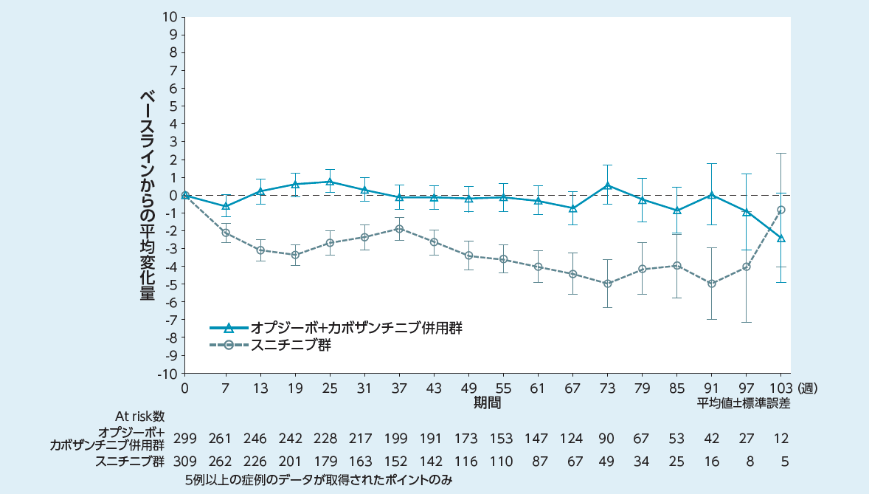
FKSI-19: Functional Assessment of Cancer Therapy-Kidney Symptom Index 19
小野薬品工業:国際共同第Ⅲ相(ONO-4538-81/CA2099ER)試験成績(社内資料)承認時評価資料
4. 効能又は効果(一部抜粋)
根治切除不能又は転移性の腎細胞癌
5. 効能又は効果に関連する注意(一部抜粋)
5.4 化学療法未治療患者に対してイピリムマブ(遺伝子組換え)と併用する場合、IMDC注)リスク分類がintermediate又はpoorリスクの患者を対象とすること。
5.5 本剤の術後補助療法における有効性及び安全性は確立していない。
5.6 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.12-17.1.14参照]
注) International Metastatic RCC Database Consortium
6. 用法及び用量(一部抜粋)
〈根治切除不能又は転移性の腎細胞癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
カボザンチニブと併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
化学療法未治療の根治切除不能又は転移性の腎細胞癌に対してイピリムマブ(遺伝子組換え)と併用する場合
は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを3週間間隔で4回点滴静注する。その後、ニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能又は転移性の腎細胞癌〉
7.5 化学療法未治療患者及びサイトカイン製剤のみの治療歴を有する患者に対する本剤単独投与の有効性及び安全性は確立していない。

















