CheckMate 142試験(海外第Ⅱ相試験)概要
がん化学療法後に増悪した治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌を対象とした海外第Ⅱ相試験:CheckMate142(海外データ)
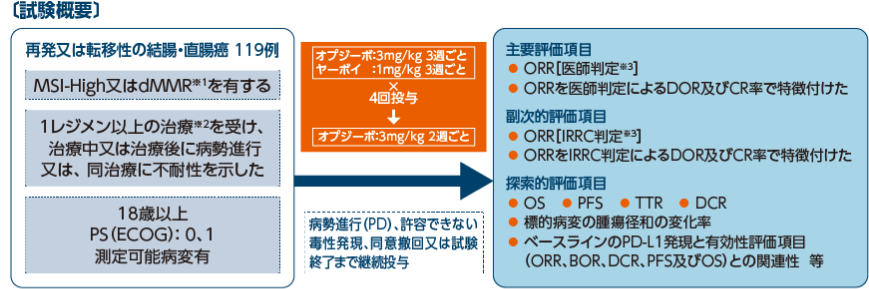
試験概要
併用療法コホート
データカットオフ:2017年7月6日
小野薬品工業 / ブリストル・マイヤーズ スクイブ :海外第Ⅱ相(CA209142)試験成績(社内資料) 承認時評価資料
- 本邦では、オプジーボ併用療法適応外
- 治療は、フッ化ピリミジン系抗悪性腫瘍剤、オキサリプラチン(L-OHP)又はイリノテカン(CPT-11)を含む
- RECISTガイドライン1.1版に基づく
【目的】
MSI-High又はdMMRを有し、フッ化ピリミジン系抗悪性腫瘍剤を含む化学療法の施行中もしくは施行後に進行した、又は同療法に不耐性を示した再発又は転移性の結腸・直腸癌に対するオプジーボとヤーボイの併用投与の有効性及び安全性について検討する。
【試験デザイン】
多施設共同非盲検非対照第Ⅱ相試験
【解析計画】
(一部抜粋)
主要評価項目:医師判定によるORR及びその両側95%信頼区間はClopper-Pearson法により算出した。ORRはDOR及びCR率により特徴付けることとした。BORは、RECISTガイドライン1.1版を用いて試験実施施設の医師が評価し、BORがCR又はPRと確定したMSI-Highの症例のDORをKaplan-Meier法を用いて推定した。DORの中央値及びその両側95%信頼区間は二重対数変換法に基づいて算出した。
副次的評価項目:IRRCが判定したORRも主要評価項目と同様に評価し、上述と同様にIRRCの判定に基づくDOR及びCR率により特徴付けることとした。
探索的評価項目:OS及びPFSは、Kaplan-Meier法を用いて推定し、中央値及びその両側95%信頼区間を二重対数変換法に基づいて算出した。また、生存率及び無増悪生存率の集計時点は、6、12、18、24、36、48、60ヵ月時点(無増悪生存率は3、9ヵ月時点も含む)とした。
TTRは、 Kaplan-Meier法を用いて解析した。DCR及びその両側95%信頼区間はClopper-Pearson法を用いて算出した。
サブグループ解析: 解析計画の有効性で設定された評価項目(ORR、BOR、DOR、TTR、DCR、PFS及びOS)において規定されたフッ化ピリミジン系抗悪性腫瘍剤(フルオロウラシル、カペシタビン)、オキサリプラチン及びイリノテカン(以下、5-FU/L-OHP/CPT-11)の治療歴を有する患者集団を対象としたサブグループ解析を行った。
MSI-High:高頻度マイクロサテライト不安定性、dMMR:ミスマッチ修復機能欠損、 ORR:奏効率、DOR:奏効期間、CR率:完全奏効率、BOR:最良総合効果、IRRC:独立画像判定委員会、OS:全生存期間、PFS:無増悪生存期間、TTR:奏効に至るまでの期間、DCR:病勢制御率
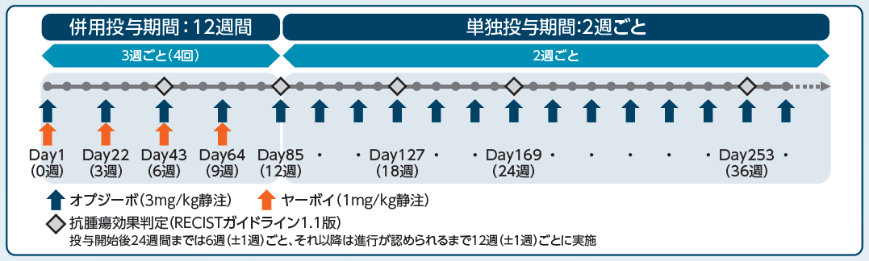
投与方法
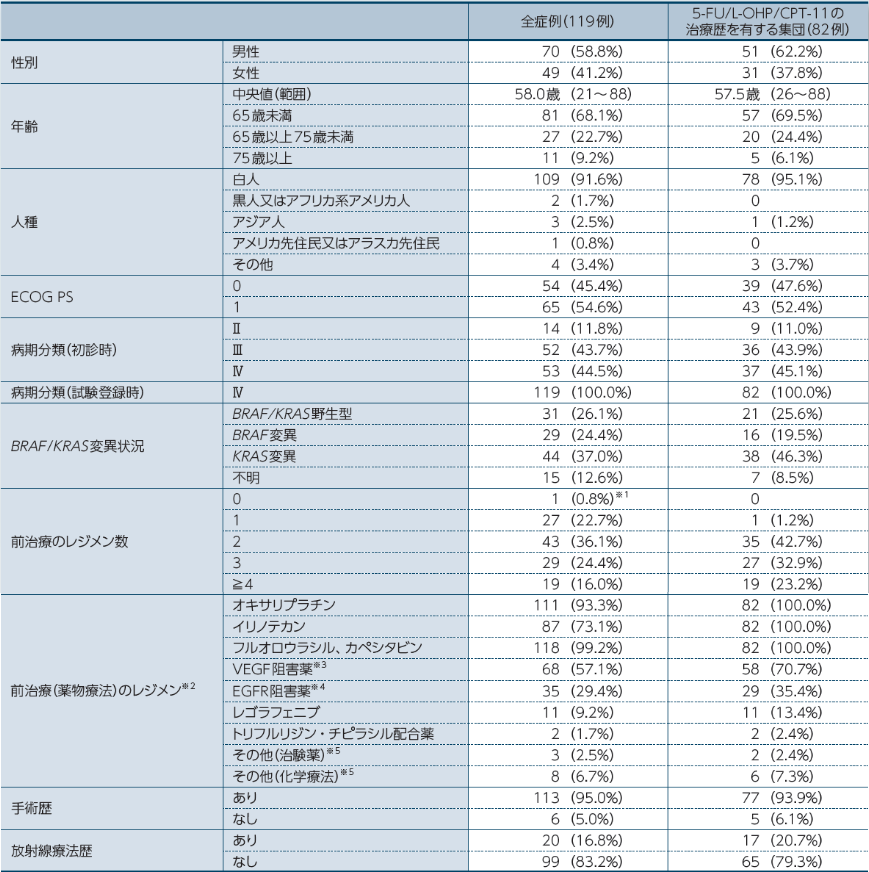
患者背景(全症例、5-FU/L-OHP/CPT-11の治療歴を有する集団)
- 化学療法を拒否し、試験に登録した症例。本邦では、オプジーボ併用療法適応外
- 複数の治療を受けた症例を含む
- ベバシズマブ、アフリベルセプト、ラムシルマブ
- セツキシマブ、パニツムマブ
- 本邦未承認薬を含む
単独療法コホート
【目的】
MSI-High又はdMMR※4を有し、フッ化ピリミジン系抗悪性腫瘍剤を含む化学療法※5の施行中もしくは施行後に進行した、又は同療法に不耐性を示した再発又は転移性の結腸・直腸癌に対するオプジーボの有効性及び安全性について検討する。
【試験デザイン】
多施設共同非盲検非対照第Ⅱ相試験
【対象】
MSI-High又はdMMRを有し、フッ化ピリミジン系抗悪性腫瘍剤を含む化学療法の施行中もしくは施行後に進行した、又は同療法に不耐性を示した再発又は転移性の結腸・直腸癌患者74例※6
【投与方法】
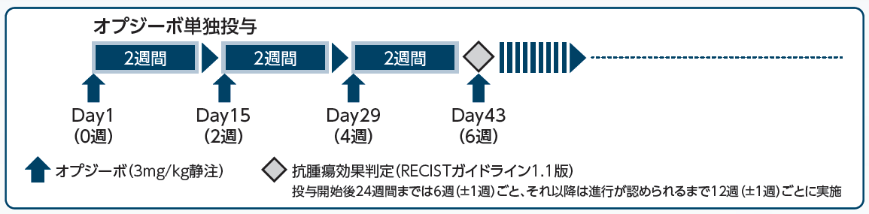
オプジーボ3mg/kgを2週間間隔で60分かけて点滴静注した。
【評価項目】
主要評価項目:ORR[医師判定※7]、ORRを医師判定によるDOR及びCR率で特徴付けた。副次的評価項目:ORR[IRRC判定※7]、ORRをIRRC判定によるDOR及びCR率で特徴付けた。探索的評価項目:OS、PFS など
【解析計画】
(一部抜粋)
主要評価項目:医師判定によるORR及びその両側95%信頼区間はClopper-Pearson法により算出した。ORRはDOR及びCR率により特徴付けることとした。BORは、RECISTガイドライン1.1版を用いて試験実施施設の医師が評価し、BORがCR又はPRと確定したMSI-Highの症例のDORをKaplan-Meier法を用いて推定した。DORの中央値及びその両側95%信頼区間は二重対数変換法に基づいて算出した。
副次的評価項目:IRRCが判定したORRも主要評価項目と同様に評価し、上述と同様にIRRCの判定に基づくDOR及びCR率により特徴付けることとした。
探索的評価項目:OS及びPFSは、Kaplan-Meier法を用いて推定し、中央値及びその両側95%信頼区間を二重対数変換法に基づいて算出した。また、生存率及び無増悪生存率の集計時点は、6、12、18、24、36、48、60ヵ月時点(無増悪生存率は3、9ヵ月時点も含む)とした。
サブグループ解析: 解析計画の有効性で設定された評価項目(ORR、BOR、DOR、TTR、DCR、PFS及びOS)において規定されたフッ化ピリミジン系抗悪性腫瘍剤(フルオロウラシル、カペシタビン)、オキサリプラチン及びイリノテカン(以下、5-FU/L-OHP/CPT-11)の治療歴を有する患者集団を対象としたサブグループ解析を行った。
※4:本邦では、オプジーボ適応外
※5:治療は、フッ化ピリミジン系抗悪性腫瘍剤、オキサリプラチン(L-OHP)又はイリノテカン(CPT-11)を含む
※6:化学療法を拒否した(前治療のレジメン数0の)症例が1例含まれる。本邦では、当該症例はオプジーボ適応外
※7:RECISTガイドライン1.1版に基づく
投与方法
有効性
併用療法コホート
奏効率(ORR)[医師判定]〔主要評価項目〕

[ ]:95% CI ※1:Clopper-Pearson法
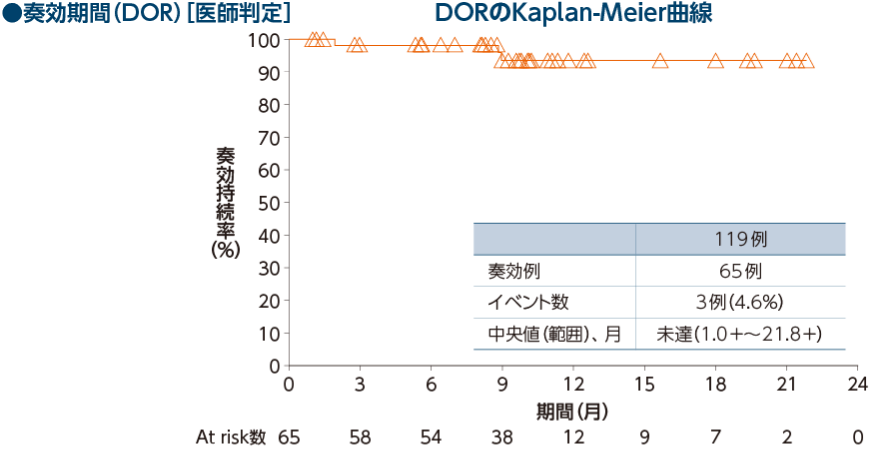
医師判定による奏効率(ORR)は54.6%(65/119例)[95% CI:45.2, 63.8]※1でした。
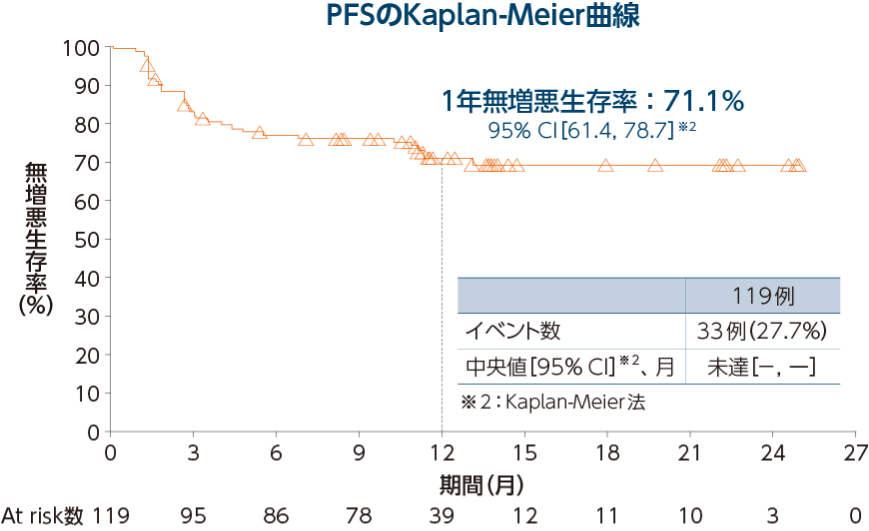
無増悪生存期間(PFS)[医師判定]〔探索的評価項目〕
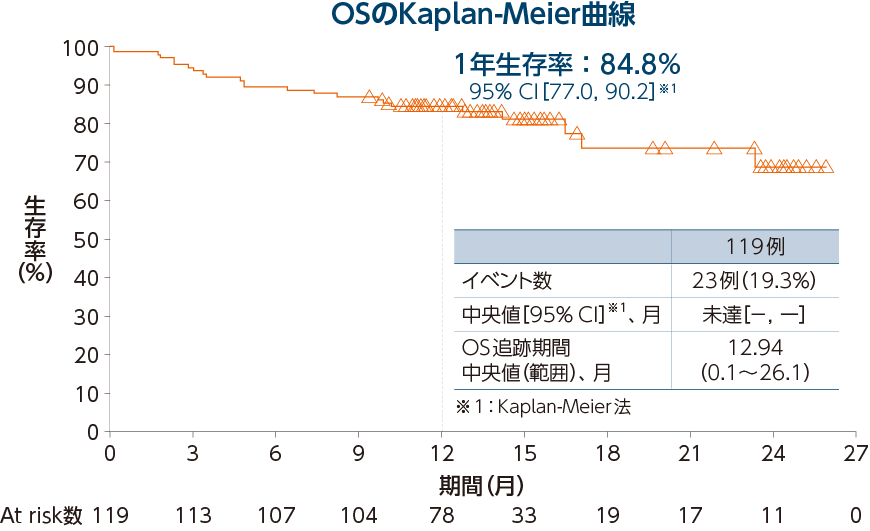
全生存期間(OS)〔探索的評価項目〕
5-FU/L-OHP/CPT-11の治療歴を有する集団における有効性
ORR[医師判定]〔主要評価項目・サブグループ解析〕

[ ]:95% CI
●DOR[医師判定]
5-FU/L-OHP/CPT-11の治療歴を有する集団において、奏効が認められた43例におけるDORの中央値は未達(範 囲:1.0+~21.8+ヵ月)でした。
5-FU/L-OHP/CPT-11の治療歴を有する集団において、医師判定によるORRは52.4%(43/82例)[95% CI:41.1,63.6]※2でした。
PFS[医師判定]、OS〔探索的評価項目・サブグループ解析〕
PFS
5-FU/L-OHP/CPT-11の治療歴を有する集団において、医師判定によるPFSの中央値は未達[95% CI:-, -]※3、1年無増悪生存率は72.2%[95% CI:60.2, 81.1]※3でした。
OS
5-FU/L-OHP/CPT-11の治療歴を有する集団において、 OSの中央値は未達[95% CI:-, -]※3、1年生存率は87.8%[95% CI:78.4, 93.2]※3であり、OSの追跡期間中央値は、13.11ヵ月(範囲:0.1~26.1ヵ月)でした。
※2:Clopper-Pearson法
※3:Kaplan-Meier法
単独療法コホート
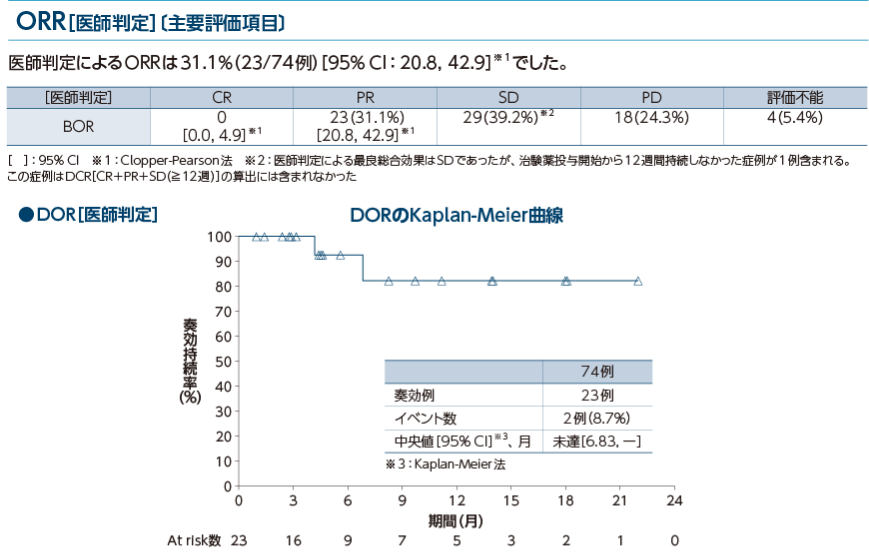
オプジーボ単独療法の奏効率(医師判定)は31.1%でした。
PFS[医師判定]〔探索的評価項目〕
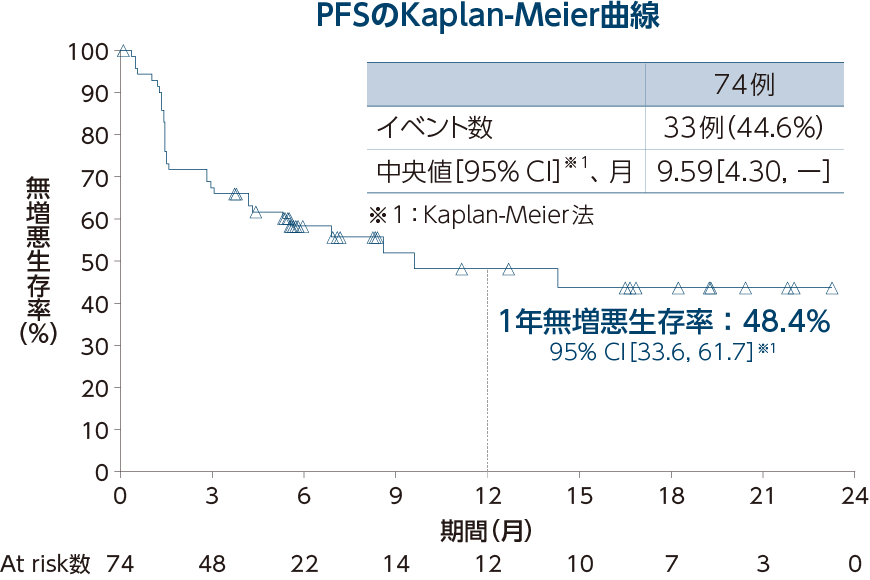
OS〔探索的評価項目〕
OSの中央値は未達[95% CI:17.12, -]※2、1年生存率は73.8%[95% CI:59.8, 83.5]※2で、OSの追跡期間中央値は7.41ヵ月(範囲:0.3〜25.3ヵ月)でした。
※2:Kaplan-Meier法
5-FU/L-OHP/CPT-11の治療歴を有する集団における有効性
ORR[医師判定]〔主要評価項目・サブグループ解析〕
5-FU/L-OHP/CPT-11の治療歴を有する集団において、医師判定によるORRは26.4%(14/53例)[95% CI:15.3,40.3]※3でした。

ORR[医師判定]〔主要評価項目・サブグループ解析〕
PFS
5-FU/L-OHP/CPT-11の治療歴を有する集団において、医師判定によるPFSの中央値は8.57ヵ月[95% CI:1.54, -]※5でした。
OS
5-FU/L-OHP/CPT-11の治療歴を有する集団において、 OSの中央値は未達[95% CI:16.33, -]※5、1年生存率は69.8%[95% CI:52.4, 81.9]※5であり、OSの追跡期間中央値は、7.23ヵ月(範囲:0.3〜24.8ヵ月)でした。
※5:Kaplan-Meier法
安全性
オプジーボ・ヤーボイ併用療法
ORR[医師判定]〔主要評価項目・サブグループ解析〕

※1 1%以上に認められた重篤な副作用:大腸炎及び発熱各2.5%(3例)、腹痛、トランスアミナーゼ上昇、貧血及び急性腎障害各
1.7%(2例)
※2 1%以上に認められた投与中止に至った副作用:自己免疫性肝炎及び急性腎障害各1.7%(2例)
なお、本試験において死亡に至った副作用は認められませんでした。
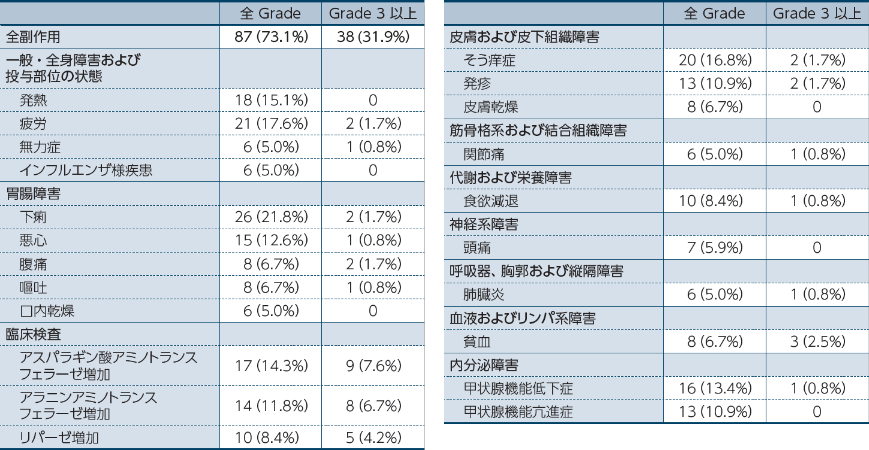
オプジーボ・ヤーボイ併用療法において、副作用は73.1%(87/119例)に認められました。
5%以上に発現した副作用一覧
留意すべき副作用
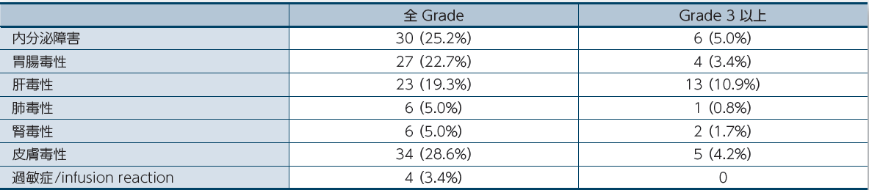
留意すべき副作用は、免疫介在性の可能性があり頻回なモニタリングと介入を必要とする副作用です。医師から報告された有害事象名は、MedDRA ver 20.0/ 20.0Jを用いて読み替え、CTCAE v4.0を用いて評価しました。因果関係は、「関連あり」、「関連なし」の2段階で評価され、「関連あり」と判定された場合に、副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。発現頻度は、治験薬の初回投与から最終投与後30日までに発現・増悪した事象を対象に集計しました。
オプジーボ単独療法
オプジーボ単独療法において、副作用は68.9%(51/74例)に認められました。
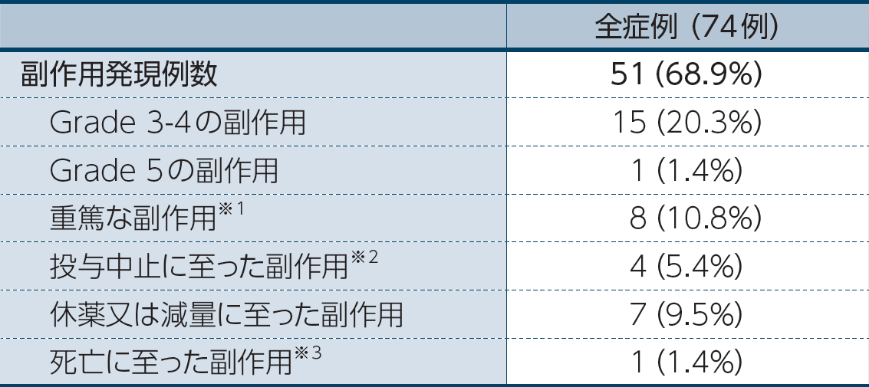
※1 重篤な副作用:大腸炎、下痢、胃炎、 口内炎、疼痛、突然死、副腎機能不全、アラニンアミノトランスフェラーゼ増加及び急性腎障害各1.4%(1例)
※2 投与中止に至った副作用:大腸炎、 口内炎、アラニンアミノトランスフェラーゼ増加及び急性腎障害各1.4%(1例)
※3 死亡に至った副作用:突然死(1例)*
* 剖検の結果、死因は原因不明
5%以上に発現した副作用一覧
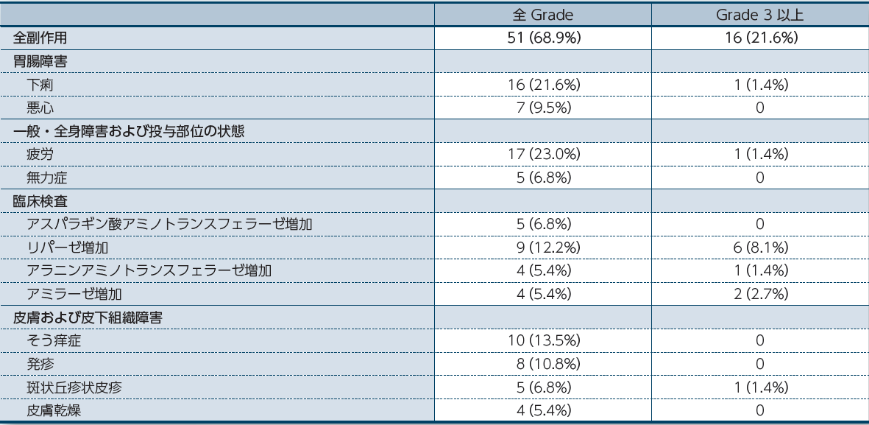
留意すべき副作用
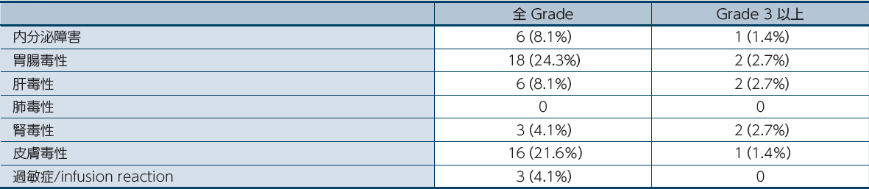
留意すべき副作用は、免疫介在性の可能性があり頻回なモニタリングと介入を必要とする副作用です。医師から報告された有害事象名は、MedDRA ver 19.0Jを用いて読み替え、CTCAE v4.0を用いて評価しました。因果関係は、「関連あり」、「関連なし」の2段階で評価され、「関連あり」と判定された場合に、副作用として集計しました。なお、「不明」と判定された場合は副作用として集計しました。発現頻度は、治験薬の初回投与から最終投与後30日までに発現した事象を対象に集計しました。
4. 効能又は効果(一部抜粋)
がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌
5. 効能又は効果に関連する注意(一部抜粋)
〈がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌〉
5.7 十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である: https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
6. 用法及び用量(一部抜粋)
〈がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌〉
通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
イピリムマブ(遺伝子組換え)と併用する場合は、通常、成人にはニボルマブ(遺伝子組換え)として、1回240mgを3週間間隔で4回点滴静注する。その後、ニボルマブ(遺伝子組換え)として、1回240mgを2週間間隔又は1回480mgを4週間間隔で点滴静注する。
7. 用法及び用量に関連する注意(一部抜粋)〈 効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
















