免疫経路の組み合わせと免疫応答の長期持続性
免疫経路の協働による、免疫応答調節
シグナル経路が組み合わされて作用することで、免疫応答が最適化されます。
- 免疫のバランスは、活性化シグナル伝達経路と抑制性シグナル伝達経路の組み合わせによって維持されます1,2。
- 抑制経路は、免疫反応を迅速にオフにする安全スイッチとして作用します3,4。
- したがって、これらの経路を介した阻害は、活性化シグナルの効果を制限する場合があります5。
- 免疫経路は、免疫応答の3つの重要な段階 「抗原提示」「浸潤」「排除」 を調節するために組み合わされて機能します6。
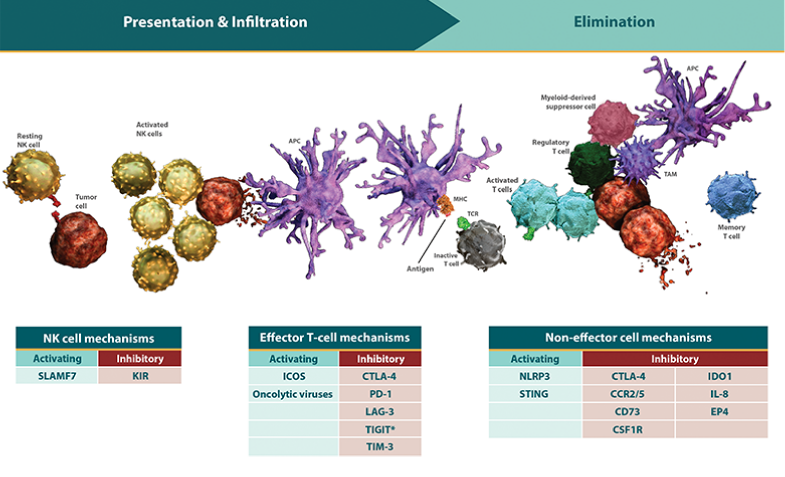
*免疫応答は自己進行的で連続的な過程です。「抗原提示」「浸潤」「排除」は、同時または連続して作用する別々の免疫経路によって調節されます7-10。
- 免疫応答の調節では、これらの経路は次の2つの役割を果たします。
- 次の段階の免疫反応の強さとその程度を制御する
- 各段階での活性化と抑制のバランスをとる - 免疫応答が一旦開始されると、各段階で、その後の段階の活性が増強または制限されます。
- 「抗原提示」が阻害されると、腫瘍に「浸潤」してがん細胞を「排除」する、細胞傷害性T細胞 の活性化および増殖が制限されます11。
の活性化および増殖が制限されます11。
- この阻害の効果は、がん細胞を「排除」する段階で作用する阻害性シグナルによって、さらに持続します12,13。
- この阻害の効果は、がん細胞を「排除」する段階で作用する阻害性シグナルによって、さらに持続します12,13。
活性化および抑制経路の組み合わせによって免疫バランスが維持されます。
- 免疫応答の各段階には、特異的な活性化受容体および抑制受容体が存在します。
- 各段階は本質的に異なるため、抗原提示を制御する経路は、がん細胞の排除を制御する経路とは異なる機能を有する可能性があります3,4,12。 - 腫瘍は、抑制経路を増幅したり、活性化経路を抑制したりすることで、免疫応答を回避し非炎症性の腫瘍(non-inflamed(cold)tumor)となります14-16。
- 活性化経路と抑制経路がどのように相互作用するかによって、免疫応答が持続するか、あるいは減弱するかが決定されます。
- 活性化経路は、T細胞またはナチュラルキラー(NK)細胞 の活性を相乗的または相加的に高めます17,18。
の活性を相乗的または相加的に高めます17,18。
- 対照的に、免疫チェックポイント経路を含む抑制経路が複数存在することは、がん細胞が免疫応答を回避する機会を増やすことにつながります19。 - したがって、これらの経路を介した抑制により、活性化シグナルの効果が制限される可能性があります5。
- 抑制シグナルと活性化シグナルがいずれも存在する場合に、エフェクター細胞 の活性を増強できるか否かは、抑制の範囲と強度に依存します5。
の活性を増強できるか否かは、抑制の範囲と強度に依存します5。
- エフェクター細胞に作用する抑制経路は、抗腫瘍活性を直接調節します3,4,9,20。
- 非エフェクター細胞
 (制御性T細胞
(制御性T細胞  、腫瘍関連マクロファージ
、腫瘍関連マクロファージ  、骨髄由来抑制細胞
、骨髄由来抑制細胞  など)に作用する抑制経路は、エフェクター細胞の活性を抑制することによって6,21-26、がん細胞の増殖を促進しますが、免疫活性を完全には阻害しない可能性があります27。
など)に作用する抑制経路は、エフェクター細胞の活性を抑制することによって6,21-26、がん細胞の増殖を促進しますが、免疫活性を完全には阻害しない可能性があります27。
- しかしながら、免疫チェックポイント経路の抑制能を増強する可能性があります。
免疫経路の調節を組み合わせることで、免疫応答が増強する可能性があります。
- 前臨床データでは、2つ以上の免疫経路を調節することで、いずれかの経路単独と比較して、より効率的に免疫応答を活性化し、炎症性腫瘍(inflamed (hot) tumor)へと導くことが示唆されています28-32。
- 現在進行中の研究では、シグナル伝達経路がどのように相互作用するかについての理解を深め、効果的に免疫応答を活性化し得る複数経路の阻害等、併用戦略を導き出すことを狙いとしています。
REFERENCES–免疫経路の組み合わせと免疫応答の長期持続性
- Leung J, Suh WK. The CD28-B7 family in anti-tumor immunity: emerging concepts in cancer immunotherapy. Immune Netw. 2014;14(6):265-276.
- Long EO, Kim HS, Liu D, Peterson ME, Rajagopalan S. Controlling natural killer cell responses: integration of signals for activation and inhibition. Ann Rev Immunol. 2013;31:227-258.
- Watzl C, Stebbins CC, Long EO. Cutting edge: NK cell inhibitory receptors prevent tyrosine phosphorylation of the activation receptor 2B4 (CD244). J Immunol. 2000;165(7):3545-3548.
- Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med. 2000;192(7):1027-1034.
- Stark S, Watzl C. 2B4 (CD244), NTB-A and CRACC (CS1) stimulate cytotoxicity but no proliferation in human NK cells. Int Immunol. 2006;18(2):241-247.
- Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39(1):1-10.
- Walunas TL, Lenschow DJ, Bakker CY, et al. CTLA-4 can function as a negative regulator of T cell activation. Immunity. 1994;1(5):405-413.
- Barber DL, Wherry EJ, Masopust D, et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 2006;439(7077):682-687.
- Workman CJ, Cauley LS, Kim IJ, Blackman MA, Woodland DL, Vignali DAA. Lymphocyte activation gene-3 (CD223) regulates the size of the expanding T cell population following antigen activation in vivo. J Immunol. 2004;172(9):5450-5455.
- Campbell KS, Purdy AK. Structure/function of human killer cell immunoglobulin-like receptors: lessons from polymorphisms, evolution, crystal structures and mutations. Immunology. 2011;132(3):315-325.
- Kim JM, Chen DS. Immune escape to PD-L1/PD-1 blockade: seven steps to success (or failure). Ann Oncol. 2016;27(8):1492-1504.
- Parry RV, Chemnitz JM, Frauwirth KA, et al. CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms. Mol Cell Biol. 2005;25(21):9543-9553.
- Intlekofer AM, Thompson CB. At the bench: preclinical rationale for CTLA-4 and PD-1 blockade as cancer immunotherapy. J Leukoc Biol. 2013;94(1):25-39.
- Spranger S, Spaapen RM, Zha Y, et al. Up-regulation of PD-L1, IDO, and Tregs in the melanoma tumor microenvironment is driven by CD8+ T cells. Sci Transl Med. 2013; 5(200):200ra116.
- Ahmadzadeh M, Johnson LA, Heemskerk B, et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood. 2009;114:1537-1544.
- Harlin H, Meng Y, Peterson AC, et al. Chemokine expression in melanoma metastases associated with CD8+ T-cell recruitment. Cancer Res. 2009;69(7):3077-3085.
- Lee SJ, Myers L, Muralimohan G, et al. 4-1BB and OX40 dual costimulation synergistically stimulate primary specific CD8 T cells for robust effector function. J Immunol. 2004;173(5):3002-3012.
- Bryceson YT, March ME, Ljunggren H-G, Long EO. Activation, co-activation, and co-stimulation of resting human NK cells. Immunol Rev. 2006;214:73-91.
- Antonia SJ, Larkin J, Ascierto PA. Immuno-oncology combinations: a review of clinical experience and future prospects. Clin Cancer Res. 2014;20(24):6258-6268.
- Cruz-Munoz ME, Dong Z, Shi X, Zhang S, Veillette A. Influence of CRACC, a SLAM family receptor coupled to the adaptor EAT-2, on natural killer cell function. Nat Immunol. 2009;10(3):297-305.
- Wing K, Onishi Y, Prieto-Martin P, et al. CTLA-4 control over Foxp3+ regulatory T cell function. Science. 2008;322(5899):271-275.
- Deaglio S, Dwyer KM, Gao W, et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression. J Exp Med. 2007;204(6):1257-1265.
- Stanley ER, Chitu V. CSF-1 receptor signaling in myeloid cells. Cold Spring Harb Perspect Biol. 2014. doi:10.1101/cshperspect.a021857.
- Fallarino F, Grohmann U, You S, et al. The combined effects of tryptophan starvation and tryptophan catabolites down-regulate T cell receptor ζ-chain and induce a regulatory phenotype in naive T cells. J Immunol. 2006;176(11):6752-6761.
- Noy R, Pollard JW. Tumor-associated macrophages: from mechanisms to therapy. Immunity. 2014;41(1):49-61.
- Marvel D, Gabrilovich DI. Myeloid-derived suppressor cells in the tumor microenvironment: expect the unexpected. J Clin Invest. 2015;125(9):3356-3364.
- Zhu Y, Knolhoff BL, Meyer MA, et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models. Clin Cancer Res. 2014;74(18):5057-5069.
- Chen S, Lee LF, Fisher TS, et al. Combination of 4-1BB agonist and PD-1 antagonist promotes antitumor effector/memory CD8 T cells in a poorly immunogenic tumor model. Cancer Immunol Res. 2014;3(2):149-160.
- Lu L, Xu X, Zhang B, Zhang R, Ji H, Wang X. Combined PD-1 blockade and GITR triggering induce a potent antitumor immunity in murine cancer models and synergizes with chemotherapeutic drugs. J Transl Med. 2014. doi:10.1186/1479-5876-12-36.
- Curran MA, Montalvo W, Yagita H, Allison JP. PD-1 and CTLA-4 combination blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors. Proc Natl Acad Sci U S A. 2010;107(9):4275-4280.
- Woo SR, Turnis ME, Goldberg MV, et al. Immune inhibitory molecules LAG-3 and PD-1 synergistically regulate T-cell function to promote tumoral immune escape. Cancer Res. 2011;72(4):917-927.
- Singh M, Vianden C, Cantwell MJ, et al. Intratumoral CD40 activation and checkpoint blockade induces T cell-mediated eradication of melanoma in the brain. Nat Commun. 2017;8(1):1447.
















