がん免疫の基本的事項
がんに対する免疫応答の本質を明らかにし、免疫応答を応用する戦略は、新規がん治療の研究において、最も重要なものとなる可能性があります。
自然免疫と獲得免疫は、がんに対する防御を相補的に行います。
- 自然免疫と獲得免疫は、病原体やがん等の脅威に対して防御するための相補的なネットワークとして機能します1。
- 免疫系は、正常細胞(自己)と外部からの脅威(非自己)とを識別することができます2-4。
- がんでは、正常細胞ががん細胞に変異し、自然免疫系と獲得免疫系によって非自己として認識されます5,6。
自然免疫:ナチュラルキラー(NK)細胞は、がんに対する迅速な抗原非依存的免疫応答に関与します。
- 自然免疫応答は、病原体およびがんに対する身体の防御の第一線として作用し、抗原非依存的に即座に反応します1,5,7。
- 恒常的に監視し、がん細胞を迅速に同定し攻撃することができます。
- 自然免疫応答の速度や範囲は、抗原特異性により限定されない一方で、正常細胞を保護するよう制御されています。標的細胞からの活性化シグナルと抑制シグナルを認識して、自己と非自己とを識別することで、正常細胞を温存しながらがん細胞を排除することが可能となります8-10。 - NK細胞は、自然免疫系の主要なエフェクター細胞です11,12。
- NK細胞
 は、活性化受容体と結合することによってがん細胞を非自己として認識し、破壊の標的とします9。
は、活性化受容体と結合することによってがん細胞を非自己として認識し、破壊の標的とします9。
獲得免疫:細胞傷害性T細胞は、がんに対する抗原特異的かつ持続的な免疫応答に関与します。
- 獲得免疫応答は抗原特異的であり、持続的な応答をもたらします1,7。
- 即時に反応はできませんが、一度活性化されると、獲得免疫応答は免疫記憶を介して維持されます13。
- 細胞傷害性T細胞
 は獲得免疫系のエフェクター細胞
は獲得免疫系のエフェクター細胞  です1。
です1。
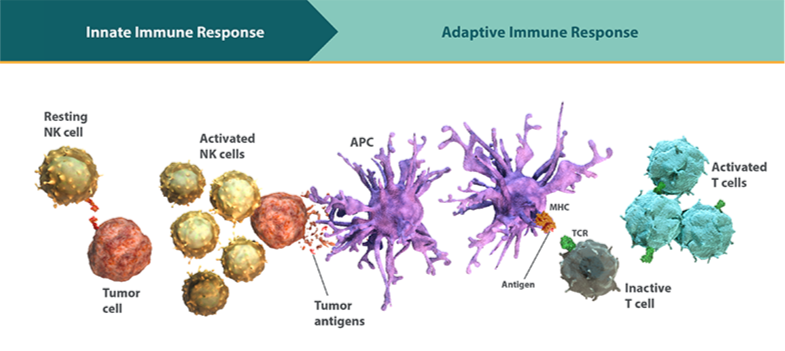
抗原提示細胞(APC)は自然免疫と獲得免疫の間をつなぐメッセン ジャーです。
- 樹状細胞などのAPC
 は、自然免疫の構成要素であり、自然免疫応答と獲得免疫応答の間をつなぐ中心的なメッセンジャーとして働きます1。
は、自然免疫の構成要素であり、自然免疫応答と獲得免疫応答の間をつなぐ中心的なメッセンジャーとして働きます1。
- がんでは、自然免疫系によりがん細胞が殺傷され、DNA、アデノシン三リン酸(ATP)、タンパク質等のシグナル伝達分子が放出され、その結果、APCによる獲得免疫応答が引き起こされます14-17。
APCによる炎症性サイトカイン産生は抗腫瘍免疫応答を増強します。
- 死滅したがん細胞はDNAやATPを放出し、APCを刺激して炎症性サイトカインを産生させ、T細胞を活性化して腫瘍の炎症を促進します17,18。
- APCがこれらのサイトカインを産生する方法の1つとして、インフラマソームと呼ばれるタンパク質複合体を形成することが挙げられます19,20。
- インフラマソームで活性化されたサイトカインにより、獲得免疫応答に関与する活性化T細胞の抗腫瘍機能と生存がサポートされます17,19。
APCががん抗原を処理して提示することで、T細胞はがん細胞を認識しやすくなります。
- 死滅したがん細胞はタンパク質を放出し、そのタンパク質はAPCで処理されてがん抗原となります21,22。
- APCはこの抗原を提示し、T細胞ががん細胞を認識するためのプライミングを行います1,22。
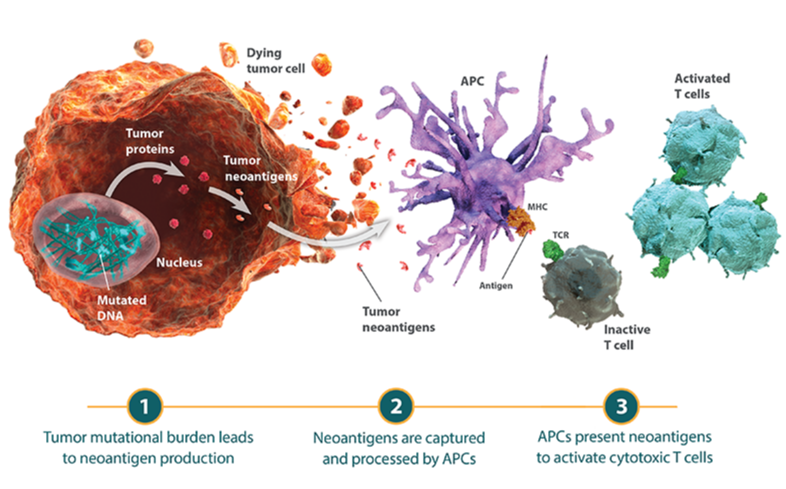
ネオアンチゲン(Neoantigen)はT細胞ががん細胞を非自己として認識する能力を促進します。
- ネオアンチゲンは、がん細胞のDNA変異に由来して作られる、正常細胞とは異なる特徴をもつ抗原であり、これにより免疫系はがん細胞を非自己として認識することができます6,23。
- がん細胞のDNA中の体細胞突然変異の総数は腫瘍遺伝子変異量(TMB)と呼ばれ、一部のがん腫で他のがん腫よりも遺伝子変異量が高値であることが知られています24-27。
- 腫瘍微小環境における細胞傷害性T細胞浸潤は、TMBの多寡との相関が示唆されています。すなわち、産生されるネオアンチゲンが多ければ多いほど、T細胞の活性化および浸潤の可能性が高くなります28,29。
自然免疫と獲得免疫の相互作用により、抗原提示、T細胞浸潤および 排除という重要な段階を通じて、外部からの脅威は認識、破壊されて います。
- 自然免疫応答、獲得免疫応答のいずれにおいても、免疫系の細胞はがん細胞のような異常細胞を認識し、排除する能力をもっています。
- 免疫応答の3つの重要な段階:
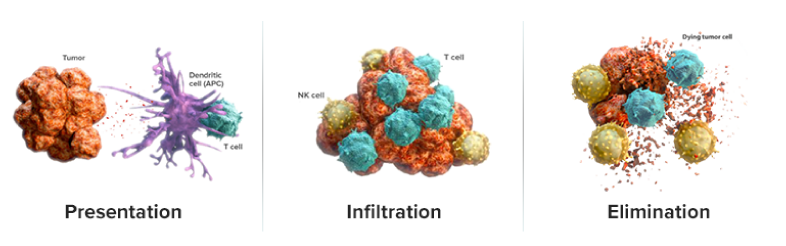
免疫応答の主要な段階「抗原提示」「浸潤」「排除」の模式図
- 抗原提示(Presentation):自然免疫系はがん細胞を迅速に同定して攻撃し、死滅させます。 この過程で、がん抗原が放出され、獲得免疫系の細胞傷害性T細胞が活性化されます15,30。
- 浸潤(Infiltration):免疫細胞は、がん抗原や他の因子によって腫瘍局所に誘引され、浸潤してがん細胞を攻撃します30。
- 排除(Elimination):活性化された細胞傷害性T細胞は、がん細胞を認識し排除の対象とします30。
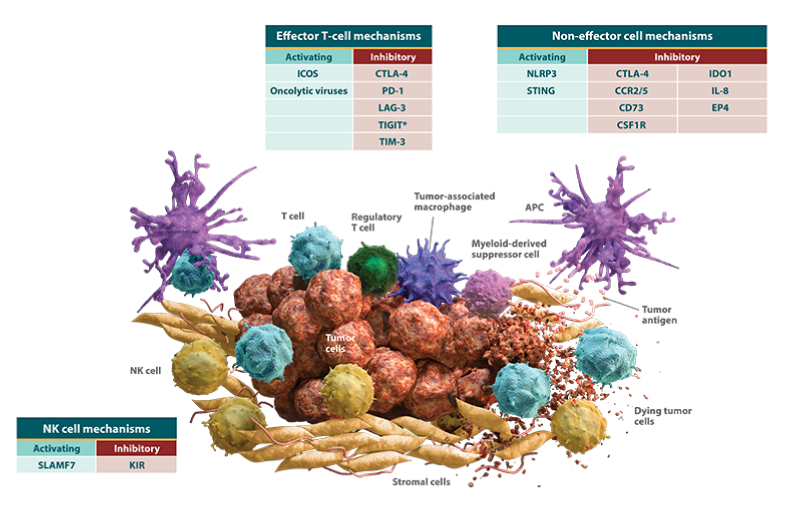
活性化経路と抑制経路のバランスにより抗腫瘍免疫応答が制御されます。
- NK細胞および細胞傷害性T細胞の抗腫瘍活性は、活性化経路および抑制経路のネットワークを介して制御されます4,31,32。
- 活性化経路は免疫応答を誘導しますが、免疫チェックポイント経路のような抑制経路は免疫の活性化を抑制します。
これにより、正常細胞を保護しながら、免疫系はがん細胞を攻撃することができます32。
がん細胞は活性化ネットワークと抑制ネットワークを利用して免疫系からの攻撃を回避します。
- 活性化経路と抑制経路の複雑なネットワークにより、抗腫瘍免疫応答はがん細胞発生のあらゆるポイントでがん細胞を検出し、排除することができます。
- しかしながら、腫瘍は、生体に備わっているがん細胞に対する攻撃を回避または抑制するために、抗腫瘍免疫応答の裏をかき、増殖に有利となるよう進化します。
がん細胞は、免疫応答を抑制するとともに、抗腫瘍免疫の回避に寄与する抑制性免疫細胞および間質細胞を動員します。
腫瘍微小環境は免疫細胞の浸潤の程度により、炎症性(hot)または 非炎症性(cold)に分類されます。
- 腫瘍はタイプにより、様々な免疫回避戦略をとっており、これによって抗腫瘍免疫反応の違いが生じます37。
- 腫瘍は、免疫細胞の浸潤の程度によって、「非炎症性腫瘍(cold tumor)」と「炎症性腫瘍(hot tumor)」に分類されます37,38。
非炎症性腫瘍は、がん抗原の提示およびT細胞の浸潤を障害することで、免疫系による排除を回避します。
非炎症性腫瘍と炎症性腫瘍
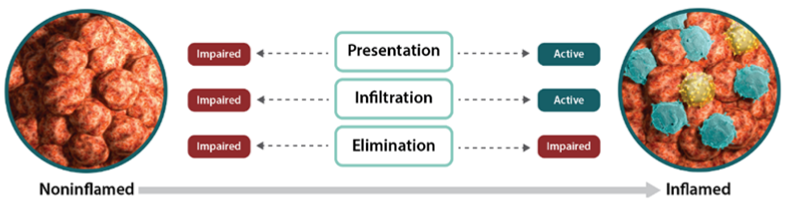
- 腫瘍微小環境には免疫細胞(特に細胞傷害性T細胞)がみられますが、非炎症性腫瘍では免疫細胞がほとんどみられません35,37。
- 非炎症性腫瘍では、がん抗原をT細胞に提示し、腫瘍特異的T細胞を腫瘍環境に誘導する能力が障害されています37,39。
- これらの腫瘍では、免疫細胞を腫瘍に動員するための重要な分泌因子であるケモカインが発現しない場合があり、腫瘍特異的T細胞の浸潤が抑制されている可能性があります4。
- さらに、こうした要因により、細胞傷害性T細胞の活性化と腫瘍への遊走が制限され、最終的にがん細胞の排除が妨げられます41,42。 - 免疫細胞がほとんど存在せず、排除を逃れる必要がないため、腫瘍での抑制性タンパク質の発現は低い状況です41,42。
炎症性腫瘍は、抑制性タンパク質の発現を上昇させ、免疫系からの攻撃を回避します。
- 炎症性腫瘍は、免疫細胞の存在を特徴とし、免疫応答が既に起きている状況を示します37,40,43-45。
- 進行した固形がんの主なサブセットでは、T細胞による炎症を伴う腫瘍微小環境が存在することを示唆するデータが蓄積されています43。
- これらのがんのTMBは高く、がん抗原を多く産生するため、多様な細胞傷害性T細胞が動員されます29,37。 - 非炎症性腫瘍と比較して、炎症性腫瘍では抗原提示およびT細胞活性化がより活発であり、ケモカインの発現により活性化された細胞傷害性T細胞が腫瘍環境に浸潤することが可能となります40,46-48。
- これらの免疫エフェクター細胞による認識および破壊を回避するため、がん細胞は、抑制性タンパク質の発現を上昇させている可能性があります42,49。
- これを達成するための1つの機構は、BET(Bromodomain and extraterminal domain)ファミリータンパク質のような制御因子の発現を上昇させることです50-52。
- この抑制的な機序により、細胞傷害性T細胞ががん細胞を排除することが妨げられ、腫瘍微小環境にがん細胞と免疫細胞が共存する状況が生じます42,46。
腫瘍微小環境は非炎症性から炎症性へ転換できます。

腫瘍微小環境は非炎症性から炎症性へ転換できます。
- 非炎症性腫瘍で障害されている免疫応答の基本的な段階「抗原提示」「浸潤」「排除」を再び機能させることは、がん免疫学の広範な可能性を示す重要な戦略の1つです。
- 抗腫瘍免疫に対する感受性を高めるために腫瘍内の炎症を促進することを目的とした研究が進行中です。
非炎症性から炎症性への転換:がん抗原提示の増強
- がん抗原は、非炎症性腫瘍では少ないと考えられるものの、獲得免疫による抗腫瘍免疫応答の開始に必須の要素です1,37。
- 変異した腫瘍特異的タンパク質に加えて、がん細胞上に高度に発現するタンパク質も、潜在的に細胞傷害性T細胞を活性化することができるがん抗原として機能する可能性があります53-55。
- 前臨床データでは、化学療法剤、放射線照射、腫瘍溶解性ウイルスの感染等の細胞傷害性因子により、がん細胞の死滅が亢進すると、がん抗原の放出が促進され、免疫応答が開始されることが示唆されています56-62。
- 他の前臨床データでは、ワクチンによりがん抗原がAPCに導入され、細胞傷害性T細胞の機能が刺激されることが示唆されています63,64。
- 加えて、がん抗原提示と獲得免疫応答の両者を最適化することで、炎症性の腫瘍環境をさらに促進できる可能性があります35。
非炎症から炎症性への転換:自然免疫の構成要素の増強
- 自然免疫系の構成要素により活性化シグナルが伝達されると、APCによるT細胞のプライミングが増え、腫瘍微小環境への免疫細胞の浸潤が増加します18,35,65。
- 前臨床研究では、自然免疫のこれらの要素を刺激することで、細胞傷害性T細胞の非炎症性腫瘍への浸潤が増加することが示唆されています66,67。

非炎症性から炎症性への転換:ケモカイン産生の増強
- 非炎症性腫瘍ではケモカインの発現はほとんどないか全くみられず、T細胞の動員が障害されています40。
- 前臨床データでは、放射線照射等によるケモカイン産生の刺激は、細胞傷害性T細胞の動員を回復し、腫瘍環境への浸潤を促進することが示唆されています58,68。
- 複数の免疫経路を刺激もしくは抑制することにより(ケモカイン産生亢進と免疫チェックポイント阻害剤など)、腫瘍微小環境への免疫細胞浸潤がさらに促進されることが示唆されています35。
REFERENCES–I-Oの基本事項
- Warrington R, Watson W, Kim HL, Antonetti FR. An introduction to immunology and immunopathology. Allergy Asthma Clin Immunol. 2011;7(suppl 1):S1. doi:10.1186/1710-1492-7-S1-S1.
- Van Parijs L, Abbas AK. Homeostasis and self-tolerance in the immune system: turning lymphocytes off. Science. 1998;280(5361):243-248.
- Mapara MY, Sykes M. Tolerance and cancer: mechanisms of tumor evasion and strategies for breaking tolerance. J Clin Oncol. 2004;22(6):1136-1151.
- Leung J, Suh W-K. The CD28-B7 family in anti-tumor immunity: emerging concepts in cancer immunotherapy. Immune Netw. 2014;14(6):265-276.
- Cheng M, Chen Y, Xiao W, Sun R, Tian Z. NK cell-based immunotherapy for malignant diseases. Cell Mol Immunol. 2013;10(3):230-252.
- Lu Y-C, Robbins PF. Cancer immunotherapy targeting neoantigens. Semin Immunol. 2016;28(1):22-27.
- Dranoff G. Cytokines in cancer pathogenesis and cancer therapy. Nat Rev Cancer. 2004;4(1):11-22.
- Bryceson YT, Ljunggren H-G, Long EO. Minimal requirement for induction of natural cytotoxicity and intersection of activation signals by inhibitory receptors. Blood. 2009;114(13):2657-2666.
- Campbell KS, Purdy AK. Structure/function of human killer cell immunoglobulin-like receptors: lessons from polymorphisms, evolution, crystal structures and mutations. Immunology. 2011;132(2):315-325.
- Martinet L, Smyth MJ. Balancing natural killer cell activation through paired receptors. Nat Rev Immunol. 2015;15:243-254.
- Vivier E, Raulet DH, Moretta A, et al. Innate or adaptive immunity? The example of natural killer cells. Science. 2011;331(6013):44-49.
- Gismondi A, Stabile H, Nisti P, Santoni A. Effector functions of natural killer cell subsets in the control of hematological malignancies. Front Immunol. 2015;6:567. doi:10.3389/fimmu.2015.00567.
- Lau LL, Jamieson BD, Somasundaram T, Ahmed R. Cytotoxic T-cell memory without antigen. Nature. 1994;369(6482):648-652.
- Ghiringhelli F, Apetoh L, Tesniere A, et al. Activation of the NLRP3 inflammasome in dendritic cells induces IL-1β–dependent adaptive immunity against tumors. Nat Med. 2009;15(10):1170-1178.
- Liu C, Lou Y, Lizée G, et al. Plasmacytoid dendritic cells induce NK cell–dependent, tumor antigen–specific T cell cross-priming and tumor regression in mice. J Clin Invest. 2008;118(3):1165-1175.
- Zhang Q, Zhu B, Li Y. Resolution of cancer-promoting inflammation: a new approach for anticancer therapy. Front Immunol. 2017;8:71. doi:10.3389/fimmu.2017.00071.
- Zitvogel L, Galluzzi L, Kepp O, Smyth MJ, Kroemer G. Type I interferons in anticancer immunity. Nat Rev Immunol. 2015;15(7):405-414.
- Woo S-R, Fuertes MB, Corrales L, et al. STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors. Immunity. 2014;41(5):830-842.
- He Y, Hara H, Núñez G. Mechanism and regulation of NLRP3 inflammasome activation. Trends Biochem Sci. 2016;41(12):1012-1021.
- Shao B-Z, Xu Z-Q, Han B-Z, Su D-F, Liu C. NLRP3 inflammasome and its inhibitors: a review. Front Pharmacol. 2015;6:262. doi:10.3389/fphar.2015.00262.
- Dhodapkar MV, Dhodapkar KM, Palucka AK. Interactions of tumor cells with dendritic cells: balancing immunity and tolerance. Cell Death Differ. 2008;15(1):39-50.
- Storni T, Lechner F, Erdmann I, et al. Critical role for activation of antigen-presenting cells in priming of cytotoxic T cell responses after vaccination with virus-like particles. J Immunol. 2002;168(6):2880-2886.
- Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science. 2015;348(6230):69-74.
- Chalmers ZR, Connelly CF, Fabrizio D, et al. Analysis of 100,000 human cancer genomes reveals the landscape of tumor mutational burden. Genome Med. 2017;9:34. doi:10.1186/s13073-017-0424-2.
- Stratton MR, Campbell PJ, Futreal PA. The cancer genome. Nature. 2009;458(7239):719-724.
- Alexandrov LB, Nik-Zainal S, Wedge DC, et al. Signatures of mutational processes in human cancer. Nature. 2013;500(7463):415-421.
- Rizvi NA, Hellmann MD, Snyder A, et al. Mutational landscape determines sensitivity to PD-1 blockade in non–small cell lung cancer. Science. 2015;348(6230):124-128.
- Kim JM, Chen DS. Immune escape to PD-L1/PD-1 blockade: seven steps to success (or failure). Ann Oncol. 2016;27(8):1492-1504.
- Giannakis M, Mu XJ, Shukla SA, et al. Genomic correlates of immune-cell infiltrates in colorectal carcinoma. Cell Rep. 2016;15(4):857-865.
- Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39:1-10. doi:10.1016/j.immuni.2013.07.012.
- Long EO, Kim HS, Liu D, Peterson ME, Rajagopalan S. Controlling natural killer cell responses: integration of signals for activation and inhibition. Annu Rev Immunol. 2013;31:227-258.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252-264.
- Bindea G, Mlecnik B, Tosolini M, et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer. Immunity. 2013;39(4):782-795.
- Chen F, Zhuang X, Lin L, et al. New horizons in tumor microenvironment biology: challenges and opportunities. BMC Med. 2015;13:45. doi:10.1186/s12916-015-0278-7.
- Spranger S, Gajewski TF. Tumor-intrinsic oncogene pathways mediating immune avoidance. Oncoimmunology. 2016;5(3):e1086862. doi:10.1080/2162402X.2015.1086862.
- Salmon H, Donnadieu E. Within tumors, interactions between T cells and tumor cells are impeded by the extracellular matrix. Oncoimmunology. 2012;1(6):992-994.
- Hegde PS, Karanikas V, Evers S. The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition. Clin Cancer Res. 2016;22(8):1865-1874.
- Chen DS, Mellman I. Elements of cancer immunity and the cancer–immune set point. Nature. 2017;541(7637):321-330.
- Spranger S, Bao R, Gajewski TF. Melanoma-intrinsic β-catenin signaling prevents anti-tumour immunity. Nature. 2015;523(7559):231-235.
- Harlin H, Meng Y, Peterson AC, et al. Chemokine expression in melanoma metastases associated with CD8+ T-cell recruitment. Cancer Res. 2009;69(7):3077-3085.
- Taube JM, Klein A, Brahmer JR, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti–PD-1 therapy. Clin Cancer Res. 2014;20(19):5064-5074.
- Spranger S, Spaapen RM, Zha Y, et al. Up-regulation of PD-L1, IDO, and Tregs in the melanoma tumor microenvironment is driven by CD8+ T cells. Sci Transl Med. 2013;5:200. doi:10.1126/scitranslmed.3006504.
- Gajewski TF, Woo S-R, Zha Y, et al. Cancer immunotherapy strategies based on overcoming barriers within the tumor microenvironment. Curr Opin Immunol. 2013;25(2):268-276.
- Lam M, Tie J, Lee B, Desai J, Gibbs P, Tran B. Systemic inflammation – impact on tumor biology and outcomes in colorectal cancer. J Clin Cell Immunol. 2015;6:377. doi:10.4172/2155-9899.1000377.
- Ma W, Gilligan BM, Yuan J, Li T. Current status and perspectives in translational biomarker research for PD-1/PD-L1 immune checkpoint blockade therapy. J Hematol Oncol. 2016;9:47. doi:10.1186/s13045-016-0277-y.
- Gajewski TF. The next hurdle in cancer immunotherapy: overcoming the non–T-cell–inflamed tumor microenvironment. Semin Oncol. 2015;42(4):663-671.
- Zhang T, Somasundaram R, Berencsi K, et al. CXC chemokine ligand 12 (stromal cell-derived factor 1 α) and CXCR4-dependent migration of CTLs toward melanoma cells in organotypic culture. J Immunol. 2005;174:5856-5863.
- Gajewski TF, Louahed J, Brichard VG. Gene signature in melanoma associated with clinical activity: a potential clue to unlock cancer immunotherapy. Cancer J. 2010;16(4):399-403.
- Ahmadzadeh M, Johnson LA, Heemskerk B, et al. Tumor antigen–specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood. 2009;114(8):1537-1544.
- Zhu H, Bengsch F, Svoronos N, et al. BET bromodomain inhibition promotes anti-tumor immunity by suppressing PD-L1 expression. Cell Rep. 2016;16(11):2829-2837.
- Segura MF, Fontanals-Cirera B, Gaziel-Sovran A, et al. BRD4 sustains melanoma proliferation and represents a new target for epigenetic therapy. Cancer Res. 2013;73(20):6264-6276.
- Pastori C, Daniel M, Penas C, et al. BET bromodomain proteins are required for glioblastoma cell proliferation. Epigenetics. 2014;9(4):611-620.
- Fisk B, Blevins TL, Wharton JT, Ioannides CG. Identification of an immunodominant peptide of HER-2/neu protooncogene recognized by ovarian tumor-specific cytotoxic T lymphocyte lines. J Exp Med. 1995;181(6):2109-2117.
- Brezicka F-T, Olling S, Nilsson O, et al. Immunohistological detection of fucosyl-Gm1 ganglioside in human lung cancer and normal tissues with monoclonal antibodies. Cancer Res. 1989;49(5):1300-1305.
- Brezicka F-T, Holmgren J, Kalies I, Lindholm L. Tumor-cell killing by MAbs against fucosyl GM1, a ganglioside antigen associated with small-cell lung carcinoma. Int J Cancer. 1991;49(6):911-918.
- Nowak AK, Lake RA, Marzo AL, et al. Induction of tumor cell apoptosis in vivo increases tumor antigen cross-presentation, cross-priming rather than cross-tolerizing host tumor-specific CD8 T cells. J Immunol. 2003;170(10):4905-4913.
- Anyaegbu CC, Lake RA, Heel K, Robinson BW, Fisher SA. Chemotherapy enhances cross-presentation of nuclear tumor antigens. PLoS One. 2014;9(9):e107894. doi:10.1371/journal.pone.0107894.
- Kaur P, Asea A. Radiation-induced effects and the immune system in cancer. Front Oncol. 2012;2:191. doi:10.3389/fonc.2012.00191.
- Adkins I, Fucikova J, Garg AD, Agostinis P, Špíšek R. Physical modalities inducing immunogenic tumor cell death for cancer immunotherapy. Oncoimmunology. 2014;3(12):e968434. doi:10.4161/21624011.2014.968434.
- Liao Y-P, Wang C-C, Butterfield LH, et al. Ionizing radiation affects human MART-1 melanoma antigen processing and presentation by dendritic cells. J Immunol. 2004;173(4):2462-2469.
- Aurelian L. Oncolytic viruses as immunotherapy: progress and remaining challenges. Onco Targets Ther. 2016;9:2627-2637.
- Diaconu I, Cerullo V, Hirvinen MLM, et al. Immune response is an important aspect of the antitumor effect produced by a CD40L-encoding oncolytic adenovirus. Cancer Res. 2012;72(9):2327-2338.
- Steinman RM, Dhodapkar M. Active immunization against cancer with dendritic cells: the near future. Int J Cancer. 2001;94(4):459-473.
- Castle JC, Kreiter S, Diekmann J, et al. Exploiting the mutanome for tumor vaccination. Cancer Res. 2012;72(5):1081-1091.
- Fuertes MB, Kacha AK, Kline J, et al. Host type I IFN signals are required for antitumor CD8+ T cell responses through CD8α+ dendritic cells. J Exp Med. 2011;208(10):2005-2016.
- Demaria O, De Gassart A, Coso S, et al. STING activation of tumor endothelial cells initiates spontaneous and therapeutic antitumor immunity. Proc Natl Acad Sci U S A. 2015;112(50):15408-15413.
- Weiss JM, Guérin MV, Regnier F, et al. The STING agonist DMXAA triggers a cooperation between T lymphocytes and myeloid cells that leads to tumor regression. Oncoimmunology. 2017;6(10):e1346765. doi:10.1080/2162402X.2017.1346765.
- Ganss R, Ryschich E, Klar E, Arnold B, Hämmerling GJ. Combination of T-cell therapy and trigger of inflammation induces remodeling of the vasculature and tumor eradication. Cancer Res. 2002;62(5):1462-1470.
















