進行肺癌におけるPD-L1と免疫チェックポイント 阻害剤の現状と将来展望-病理医の役割とは-
開催日: 2017年4月28日
開催場所:京王プラザホテル
座長

森井 英一 先生
大阪大学大学院 医学系研究科 病態病
理学講座

谷田部 恭 先生
愛知県がんセンター中央病院 遺伝子病理診断部
出演者

西川 博嘉 先生
国立がん研究センター研究所 腫瘍免疫研究分野/先端医療開発センター 免疫TR分野 名古屋大学大学院医学系研究科 分子細胞免疫学

後藤 功一 先生
国立がん研究センター東病院 呼吸器内科

大林 千穂 先生
奈良県立医科大学 病理診断学講座

元井 紀子 先生
国立がん研究センター中央病院 病理・臨床検査科
PD-1/PD-L1阻害剤のバイオマーカーとしてのPD-L1の役割と限界
西川 博嘉 先生
国立がん研究センター研究所 腫瘍免疫研究分野/先端医療開発センター 免疫TR分野
名古屋大学大学院医学系研究科 分子細胞免疫学
PD-L1は正常な組織にも発現しているT細胞の共抑制分子
自己に対する過剰な免疫応答を制御するため、T細胞の免疫応答には、PD-1やCTLA-4などのT細胞表面分子を介した経路や制御性T細胞、骨髄由来制御性細胞など様々な因子が関与している※1。PD-1/PD-L1はT細胞の活性化を抑制する分子であり(共抑制)、免疫チェックポイント阻害薬の抗PD-1抗体はがん抗原に特異的なT細胞を活性化することで抗腫瘍効果を発揮する。※2
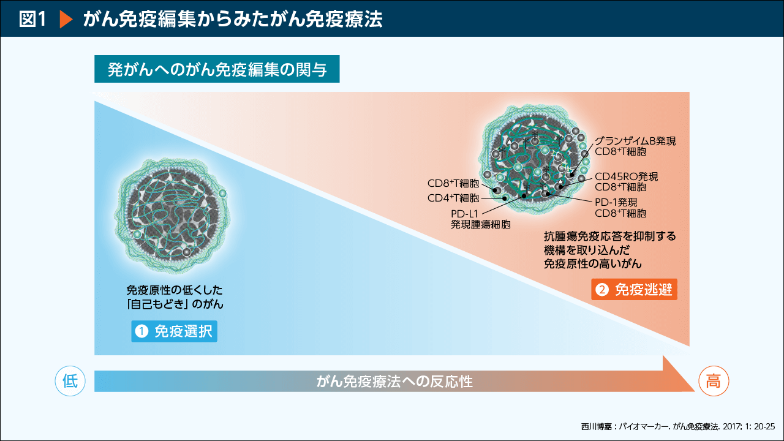
がん細胞の抗PD-1抗体への感受性の違いは、発がん過程における免疫系の関与の違いが原因の一つとして推測されている。すなわち、遺伝子変異等に由来するがん抗原は存在するものの、免疫抑制細胞や免疫抑制因子を取り込むことで積極的に免疫系から逃避した「免疫原性の高いがん」ではがん免疫療法の効果が期待できるが、免疫選択により自己に近づいた「自己もどきの免疫原性の低いがん」では、がん微小環境に免疫担当細胞の浸潤も少なく、がん免疫療法の効果も期待できない(図1)※3。すなわち、発がん過程でどちらの機構を多く採用したかによって、がん免疫療法への感受性が異なり、腫瘍組織におけるPD-L1発現は「腫瘍組織の免疫原性の高いがん」の多さを反映している指標の一つとも言える。
これからのがん免疫療法のバイオマーカー開発について
また、がん細胞に特異的ながん抗原には、自己由来のがん抗原である「がん関連抗原:シェアード抗原」とがん細胞の遺伝子変異に由来する「がん特異抗原:ネオ抗原」がある。がんの種類によって腫瘍内遺伝子変異量(TMB)が異なり、遺伝子変異にともなって生じるネオ抗原が多い腫瘍(前述の免疫原性の高いがん)と少ないがんで、抗PD-1抗体の治療効果を比較すると、ネオ抗原が多い腫瘍でPFSが良好であった(HR 0.19, 95% CI 0.08-0.47, log-rank P=0.0004)※6と報告されている。
PD-L1はがん細胞自身の変異等により発現する場合に加えて、浸潤したT細胞が分泌するインターフェロンγ等によって発現する。よって、HER2発現やEFGR変異などの腫瘍のバイオマーカーとは異なり、サロゲートマーカーの1つと理解する必要がある。バイオマーカーを考えるうえで、免疫系が「自己」と「非自己」を見分ける反応であることを理解することが重要であり、患者を1つの基準で線引きするのは困難である。個々の患者の免疫応答を理解するためにはPD-L1発現とともに、遺伝子変異によるネオ抗原やそれを認識するCD8 陽性T細胞の状態などを包括的に考慮する必要がある(図2)。
※1 日本肺癌学会:肺癌患者におけるPD-L1検査の手引き第1.0版, 2017
※2 最適使用推進ガイドライン ニボルマブ(遺伝子組み換え)~非小細胞肺癌~ 厚生労働省
※3 西川博嘉: バイオマーカー. がん免疫療法. 2017; 1: 20-25
※4 Schadendorf D, et al. J Clin Oncol. 2015: 33: 1889-1894.
※5 Borghaei H, et al. N Engl J Med 2015; 373: 1627-1639
※6 Rizvi NA, et al. Science 2015; 348: 124-128
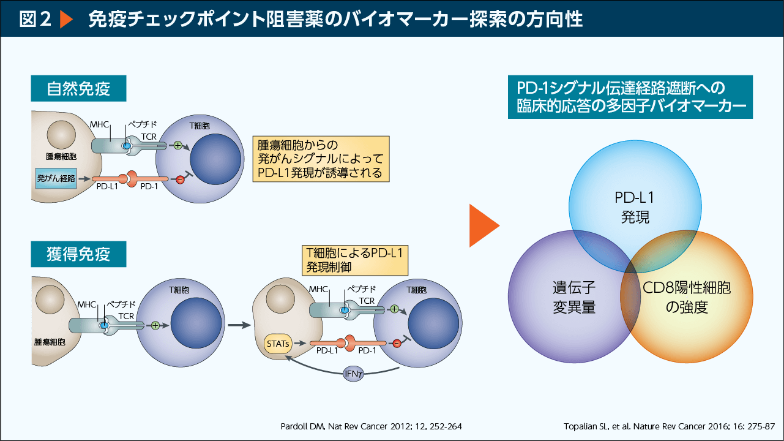
<図2:左>
a 自然免疫
腫瘍細胞 発がん経路 MHC ペプチド TCR PD-L1 PD-1 T細胞
腫瘍細胞からの発がんシグナルによってPD-L1発現が誘導される
b 獲得免疫
腫瘍細胞 MHC ペプチド TCR T細胞
STSTs MHC ペプチド TCR PD-L1 PD-1 IFNγ T細胞
T細胞によるPD-L1発現制御
Pardoll DM, Nat Rev Cancer 2012; 12, 252-264
<図2:右>
PD-1シグナル伝達経路遮断への臨床的応答の多因子バイオマーカー
PD-L1発現 遺伝子変異量 CD8陽性細胞の強度
Topalian SL, et al. Nature Rev Cancer 2016; 16: 275-87
















