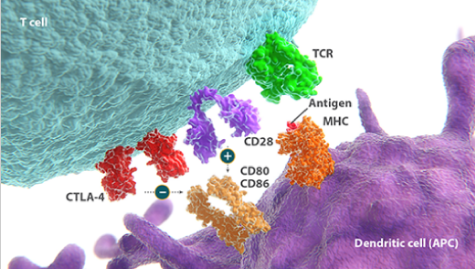
発現および生理的な機能
- CTLA-4は、活性化T細胞の表面に発現する免疫チェックポイント受容体です1,2。
- 細胞傷害性T細胞 上のCTLA-4が抗原提示細胞(APC)
上のCTLA-4が抗原提示細胞(APC)  上のCD80/86に結合すると、T細胞の活性化が阻害されます3。
上のCD80/86に結合すると、T細胞の活性化が阻害されます3。 - APC上の主要組織適合遺伝子複合体(MHC)によって抗原がT細胞受容体(TCR)に提示されることで、T細胞の活性化が始まります3。
- T細胞の完全な活性化には、さらに第2のシグナル(共刺激)が必要であり4-6、T細胞上の主要な共刺激受容体であるCD28がAPC上のCD80およびCD86に結合することで免疫応答が維持されます2,3。
- CTLA-4の発現が上昇すると、CD80/86とCD28との結合に競合します。CTLA-4の結合によりT細胞の活性化が阻害され、免疫系のバランスが保たれます6-8。
- Tregに発現するCTLA-4を介したシグナル伝達は、免疫応答を抑制的に制御します9。 - Tregは、他の免疫細胞の活性および機能を抑制することによって、過剰な免疫応答を制御する役割を担っています10-11。
- Treg上のCTLA-4の持続的発現は、そうした抑制的作用に重要です9,12。
がんでの役割
前臨床のエビデンス
- 前臨床データによると、CTLA-4特異的抗体は、T細胞およびメモリーT細胞の活性化と腫瘍環境への集積を促進し、それらの機能および生存を助けるとともに、腫瘍微小環境のTregを除去することにより、免疫応答能を賦活化することができます8,18,19。
- 一方で、CTLA-4阻害は、正常細胞に対する免疫反応をも誘発する可能性があります20。
抗腫瘍効果を最適化するために単独または他の免疫チェックポイント経路の阻害との併用によるCTLA-4阻害療法の研究開発が進められています21。
CTLA-4阻害の最適化:Tregの除去
- Tregを除去するためのアプローチの1つは、非フコシル化抗体を使用して、免疫活性を制御することです。
- 様々ながんにおける予後不良は、Tregの存在と関連しています22,23。
- フコシル化抗体と異なり、非フコシル化抗体には改変Fc領域があり、これにより、抗体依存性細胞傷害(ADCC)を媒介する免疫細胞上のFc受容体との結合が強化されます24。
強化された結合により、ADCC活性によるTreg除去作用が増強され、T細胞の活性が向上します19,24。
- マウスモデルでは、Tregの除去が進むことで、細胞傷害性T細胞の活性化および抗腫瘍活性の改善が示されています25。
CTLA-4阻害の最適化:特異性の向上
- もう1つのアプローチは、CTLA-4阻害の特異性を向上させるプロ抗体を使用する方法です。これにより、腫瘍微小環境外での抗体の結合機会を減らし、正常組織を守ることができます26,27。
- これらの抗体は、がん細胞で高度に発現するか、もしくはがん細胞上にのみ存在する酵素によって除去されるペプチドでマスクされているため、ほとんどが腫瘍部位のみで活性化されます26。
- 前臨床データでは、腫瘍微小環境のみで抗体が結合できるよう制限することで、抗腫瘍反応を維持しつつ、免疫系が正常細胞を攻撃するのを防ぐことができることが示されています27,28。
- CTLA-4阻害による免疫応答の賦活化を最適化するため、新しいアプローチが現在も研究されています。

CTLA-4は長期的な免疫にどのように関与しているのでしょうか?
CTLA-4の作用機序とメモリーT細胞活性との関連について学ぶ
REFERENCES–CTLA-4
- Perkins D, Wang Z, Donovan C, et al. Regulation of CTLA-4 expression during T cell activation. J Immunol. 1996;156(11):4154-4159.
- Le Mercier I, Lines JL, Noelle RJ. Beyond CTLA-4 and PD-1, the generation Z of negative checkpoint regulators. Front Immunol. 2015. doi:10.3389/fimmu.2015.00418.
- Chen L, Flies DB. Molecular mechanisms of T cell co-stimulation and co-inhibition. Nat Rev Immunol. 2013;13(4):227-242.
- Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade. Science. 1996; 271(5256):1734-1736.
- Linsley PS, Brady W, Grasmere L, Aruffo A, Damle NK, Ledbetter JA. Binding of the B cell activation antigen B7 to CD28 costimulates T cell proliferation and interleukin 2 mRNA accumulation. J Exp Med. 1991;173(3):721-730.
- Walunas TL, Lenschow DJ, Bakker CY, et al. CTLA-4 can function as a negative regulator of T cell activation. Immunity. 1994;1(5):405-413.
- Tivol EA, Borriello F, Schweitzer AN, Lynch WP, Bluestone JA, Sharpe AH. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity. 1995;3(5):541-547.
- Buchbinder EI, Desai A. CTLA-4 and PD-1 pathways: similarities, differences, and implications of their inhibition. Am J Clin Oncol. 2016;39(1):98-106.
- Wing K, Onishi Y, Prieto-Martin P, et al. CTLA-4 control over Foxp3+ regulatory T cell function. Science. 2008;322(5899):271-275.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012; 12(4):252-264.
- Melero I, Berman DM, Aznar MA, Koran AJ, Pérez Gracia JL, Haanen J. Evolving synergistic combinations of targeted immunotherapies to combat cancer. Nat Rev Cancer. 2015;15(8):457-472.
- Takahashi T, Tagami T, Yamazaki S, et al. Immunologic self-tolerance maintained by CD25+CD4+ regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4. J Exp Med. 2000;192(2):303-309.
- Chambers CA, Sullivan TJ, Truong T, Allison JP. Secondary but not primary T cell responses are enhanced in CTLA-4-deficient CD8+ T cells. Eur J Immunol. 1998;28(10):3137-3143.
- Lau LL, Jamieson BD, Somasundaram T, Ahmed R. Cytotoxic T-cell memory without antigen. Nature. 1994;369(6482):648-652.
- Viega-Fernandes H, Walter U, Bourgeois C, McLean A, Rocha B. Response of naïve and memory CD8+ T cells to antigen stimulation in vivo. Nat Immunol. 2000;1(1):47-53.
- Galon J, Costes A, Sanchez-Cabo F, et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 2006;313(5795):1960-1964.
- Fridman WH, Pagès F, Sautès-Fridman C, Galon J. The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer. 2012; 12(4):298-306.
- Pedicord VA, Montalvo W, Leiner IM, Allison JP. Single dose of anti–CTLA-4 enhances CD8+ T-cell memory formation, function, and maintenance. Proc Natl Acad Sci U S A. 2011;108(1):266-271.
- Simpson TR, Li F, Montalvo-Ortiz W, et al. Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti–CTLA-4 therapy against melanoma. J Exp Med. 2013; 210(9):1695-1710.
- Amos SM, Duong CPM, Westwood JA, et al. Autoimmunity associated with immunotherapy of cancer. Blood. 2011; 118(3):499-509.
- Beavis PA, Henderson MA, Giuffrida L, et al. Dual PD-1 and CTLA-4 checkpoint blockade promotes antitumor immune responses through CD4Foxp3 cell-mediated modulation of CD103 dendritic cells. Cancer Immunol Res. 2018;6(9):1069-1081.
- Saito T, Nishikawa H, Wada H, et al. Two FOXP3+CD4+ T cell subpopulations distinctly control the prognosis of colorectal cancers. Nat Med. 2016;22(6):679-684.
- Tao H, Mimura Y, Aoe K, et al. Prognostic potential of FOXP3 expression in non-small cell lung cancer cells combined with tumor-infiltrating regulatory T cells. Lung Cancer. 2012;75(1):95-101.
- Satoh M, Iida S, Shitara K. Non-fucosylated therapeutic antibodies as next-generation therapeutic antibodies. Expert Opin Biol Ther. 2006;6(11):1161-1173.
- Selby MJ, Engelhardt JJ, Quigley M, et al. Anti-CTLA-4 antibodies of IgG2a isotype enhance antitumor activity through reduction of intratumoral regulatory T cells. Cancer Immunol Res. 2013;1(1):32-42.
- Chen I-J, Chuang C-H, Hsieh Y-C, et al. Selective antibody activation through protease-activated pro-antibodies that mask binding sites with inhibitory domains. Sci Rep. 2017;7(1):11587. doi:o10.1038/s41598-017-11886-7.
- Tuve S, Chen B-M, Liu Y, et al. Combination of tumor site–located CTL-associated antigen-4 blockade and systemic regulatory T-cell depletion induces tumor-destructive immune responses. Cancer Res. 2007;67(12):5929-5939.
- Fransen MF, van der Sluis TC, Ossendorp F, Arens R, Melief CJM. Controlled local delivery of CTLA-4 blocking antibody induces CD8+ T-cell-dependent tumor eradication and decreases risk of toxic side effects. Clin Cancer Res. 2013;19(19):5381-5389.