有害事象とI-O
従来のがん治療法およびがん免疫(I-O)療法により、
それぞれの作用機序に関連した有害事象が引き起こされます。
従来のがん治療は、標的のがん細胞だけでなく、正常細胞にも影響を及ぼすことがあります。
- 多くのがん治療は正常細胞にも何らかの影響を及ぼし、有害事象を引き起こす可能性があります。
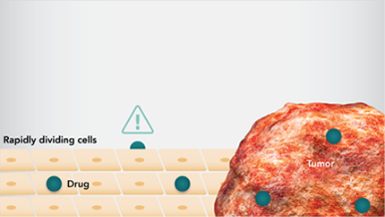
- 化学療法で用いる薬剤では、細胞周期の様々な段階を標的とし、細胞分裂を阻害して細胞死をもたらします。 - 急速に分裂するがん細胞は、化学療法の恰好の標的となりますが、同様に分裂が盛んな毛髪や皮膚、消化管の細胞など正常細胞も影響を受けることがあります1。
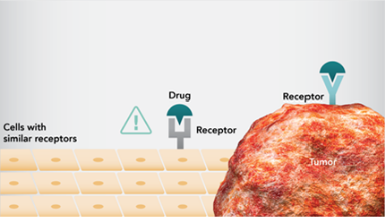
- 分子標的療法は、がんの増殖および生存に重要なシグナル伝達経路を阻害することで、抗がん作用を発揮します。 - 分子標的薬は、正常細胞に存在する同一分子や類似した分子にも作用することがあります2,3。
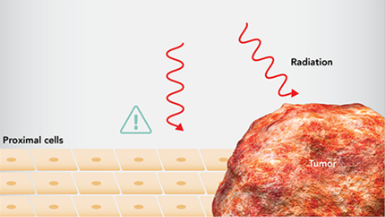
- 放射線療法は、腫瘍に隣接した正常細胞や組織にも悪影響を及ぼす可能性があります4。
がん免疫(I-O)療法は、正常細胞にも影響を及ぼす可能性があります。
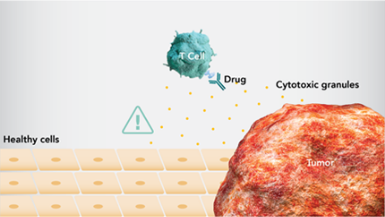
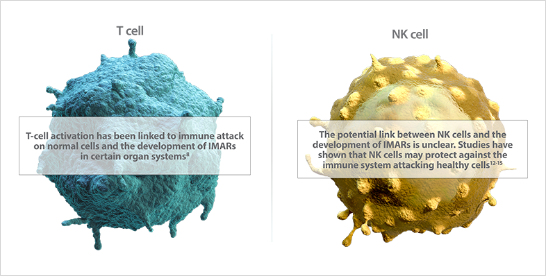
- 免疫応答は、いずれの場合(病原体、がん、その他の外部からの脅威に対する)でも、正常細胞への攻撃を引き起こす可能性があります5-7。
- I-O療法は免疫応答を賦活化し、がんの生存および増殖戦略に対抗しますが、免疫関連有害事象(irAE)を引き起こす可能性があります8,9。
- I-O療法により賦活化された免疫系が、がん細胞だけではなく、正常細胞を攻撃する場合があります。irAEは、その対象に関連した特有の有害事象として起きることになります8。
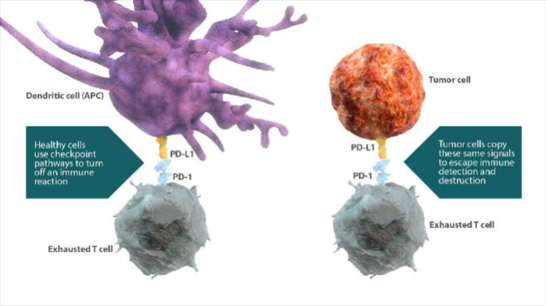
免疫系細胞の活性化状態を制御する経路とirAEとの関連が示唆されています。
- 活性化経路および抑制経路により、免疫系の細胞の活性化および免疫応答のバランスが制御されています25,26。
-これらの経路は、それぞれ免疫活性へ及ぼす影響の強さが異なり、このことが自己免疫寛容の成立に寄与しています27。 - 受容体とそのリガンドの動的な発現の変化によって、免疫応答のバランスが制御されています27。
- 特定の免疫経路の活性化または阻害とirAEとの関連も示唆されています27,28。
irAE/IMAE(免疫関連有害事象/免疫介在性有害事象)のマネジメントには、対応に向けた準備と詳細な観察が重要です。
大部分のirAEは治療開始から数週間ないし数ヵ月以内に発現しますが、治療終了後も含め、あらゆる時点で発現する可能性があります。
- irAEは様々な臓器や器官で発現しますが、その発現時期についてはそれぞれ特徴的なパターンが傾向としてみられます28-31。
- irAEは治療期間中だけでなく治療終了後にも発現する可能性があります29。 - 免疫の活性化と自己免疫の関連性を調べることにより、irAE発現についての理解が深まる可能性があります25。
irAEの発見には、医療従事者と患者さんの両方の認識が必要となります。
- irAEはあらゆる時点で発現する可能性があるため、早期の発見とマネジメントが重要となります30-34。
- そのため、患者さん、看護師およびその他の医療従事者は、がん免疫(I-O)療法の治療中から、治療を終了した後においても常に警戒し、致死的な場合もあるirAE関連の合併症の発現を最小限に抑える必要があります8,30。 - irAEの発見やマネジメントのため、医療機関への連絡について、患者教育をすることが重要となります30,31。
- 早期の発見と治療介入により、irAEは対処が可能です28,33,35。
- irAEが原因となりうる症状や兆候(臨床検査値や身体症状など)を詳細に観察していく必要があります30,31。 - 専門医へのコンサルトも必要に応じて行う必要があります36。
irAEマネジメントについて。
- irAEマネジメントのための治療アルゴリズムが作成され、多くの医療機関で実際に運用されています35,37。
加えて、最近のガイドラインでは、irAEマネジメントのために、コンセンサスが得られた推奨事項も掲載されています31,37,38。
- 早期の発見と治療介入により、irAEは対処が可能です28,33,35。
- irAEが原因となりうる症状や兆候(臨床検査値や身体症状など)を詳細に観察していく必要があります30,31。 - irAEマネジメントの原則としては、治療の延期または中止、免疫抑制剤および臓器特異的な拮抗薬の使用などがあります29,31,32,34,39。
- 個々の治療薬に関連した詳しいirAEマネジメントのガイダンスは、添付文書や適正使用ガイドなどでご確認ください。
- 免疫系の活性化について研究が進み、より多くのデータが蓄積されることで、さらに効果的なirAEの管理方法の確立が期待されます。
REFERENCES‒有害事象とI-O
- Moran P. Cellular effects of cancer chemotherapy administration. J Intraven Nurs. 2000;23(1):44-51.
- Huang M, Shen A, Ding J, et al. Molecularly targeted cancer therapy: some lessons from the past decade. Trends Pharmacol Sci. 2014;35(1):41-50.
- Joo WD, Visintin I, Mor G. Targeted cancer therapy—are the days of systemic chemotherapy numbered? Maturitas. 2013;76(4):308-314.
- Stone HB, Coleman CN, Anscher MS, McBride WH. Effects of radiation on normal tissue: consequences and mechanisms. Lancet Oncol. 2003;4(9):529-536.
- Chaplin DD. Overview of the immune response. J Allergy Clin Immunol. 2010;125(2 suppl 2):S3-23.
- Nathan C. Neutrophils and immunity: challenges and opportunities. Nat Rev Immunol. 2006;6(3):173-182.
- Thangavelu G, Gill RG, Boon L, Ellestad KK, Anderson CC. Control of in vivo collateral damage generated by T cell immunity. J Immunol. 2013;191(4):1686-1691.
- Amos SM, Duong CPM, Westwood JA, et al. Autoimmunity associated with immunotherapy of cancer. Blood. 2011;118(3):499-509.
- Chen TT. Statistical issues and challenges in immuno-oncology. J Immunother Cancer. 2013;1(1):18.
- Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age. Nature. 2011;480(7378):480-489.
- Winer A, Bodor JN, Borghaei H, et al. Identifying and managing the adverse effects of immune checkpoint blockade. J Thorac Dis. 2018;10(suppl 3):S480-S489.
- Aramaki T, Ida H, Izumi Y, et al. A significantly impaired natural killer cell activity due to a low activity on a per-cell basis in rheumatoid arthritis. Mod Rheumatol. 2009;19(3):245-252.
- Fort MM, Leach MW, Rennick DM. A role for NK cells as regulators of CD4+ T cells in a transfer model of colitis. J Immunol. 1998;161(7):3256-3261.
- Park Y-W, Kee S-J, Cho Y-N, et al. Impaired differentiation and cytotoxicity of natural killer cells in systemic lupus erythematosus. Arthritis Rheum. 2009;60(6):1753-1763.
- Zhang B, Yamamura T, Kondo T, Fujiwara M, Tabira T. Regulation of experimental autoimmune encephalomyelitis by natural killer (NK) cells. J Exp Med. 1997;186(10):1677-1687.
- Baskar R, Dai J, Wenlong N, Yeo R, Yeoh K-W. Biological response of cancer cells to radiation treatment. Front Mol Biosci. 2014;1:24. doi:10.3389/fmolb.2014.00024.
- Hubenak JR, Zhang Q, Branch CD, Kronowitz SJ. Mechanisms of injury to normal tissue after radiotherapy: a review. Plast Reconstr Surg. 2014;133(1):49e-56e.
- Jansman FGA, Sleijfer DT, de Graaf JC, Coenen JLLM, Brouwers JRBJ. Management of chemotherapy-induced adverse effects in the treatment of colorectal cancer. Drug Saf. 2001;24(5):353-367.
- Nicolson GL, Conklin KA. Reversing mitochondrial dysfunction, fatigue and the adverse effects of chemotherapy of metastatic disease by molecular replacement therapy. Clin Exp Metastasis. 2008;25(2):161-169.
- Wujcik D. Science and mechanism of action of targeted therapies in cancer treatment. Semin Oncol Nurs. 2014;30(3):139-146.
- Widakowich C, de Castro G JR, de Azambuja E, Dinh P, Awada A. Review: side effects of approved molecular targeted therapies in solid cancers. Oncologist. 2007;12(12):1443-1455.
- Liu S, Kurzrock R. Toxicity of targeted therapy: implications for response and impact of genetic polymorphisms. Cancer Treat Rev. 2014;40(7):883-891.
- Bumbaca D, Wong A, Drake E, et al. Highly specific off-target binding identified and eliminated during the humanization of an antibody against FGF receptor 4. mAbs. 2011;3(4):376-386.
- Disis ML. Mechanism of action of immunotherapy. Semin Oncol. 2014;41(suppl 5):S3-S13.
- Martinet L, Smyth MJ. Balancing natural killer cell activation through paired receptors. Nat Rev Immunol. 2015;15(4):243-254.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252-264.
- Anderson AC, Joller N, Kuchroo VK. Lag-3, Tim-3, and TIGIT: co-inhibitory receptors with specialized functions in immune regulation. Immunity. 2016;44(5):989-1004.
- Liu J, Blake SJ, Harjunpää H, et al. Assessing immune-related adverse events of efficacious combination immunotherapies in preclinical models of cancer. Cancer Res. 2016;76(18):5288-5301.
- Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med. 2018;378(2):158-168.
- Davies M, Duffield EA. Safety of checkpoint inhibitors for cancer treatment: strategies for patient monitoring and management of immune-mediated adverse events. Immunotargets Ther. 2017;6:51-71.
- Champiat S, Lambotte O, Barreau E, et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol. 2016;27(4):559-574.
- Kumar V, Chaudhary N, Garg M, et al. Current diagnosis and management of immune related adverse events (irAEs) induced by immune checkpoint inhibitor therapy. Front Pharmacol. 2017;8:49. doi:10.3389/fphar.2017.00049.
- Michot JM, Bigenwald C, Champiat S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer. 2016;54:139-148.
- Martins F, Sykiotis GP, Maillard M, et al. New therapeutic perspectives to manage refractory immune checkpoint-related toxicities. Lancet Oncol. 2019;20(1):e54-e64.
- Gelao L, Criscitiello C, Esposito A, Goldhirsch A, Curigliano G. Immune checkpoint blockade in cancer treatment: a double-edged sword cross-targeting the host as an “innocent bystander.” Toxins (Basel). 2014;6(3):914-933.
- Sznol M, Postow MA, Davies MJ, et al. Endocrine-related adverse events associated with immune checkpoint blockade and expert insights on their management. Cancer Treat Rev. 2017;58:70-76.
- Brahmer JR, Lacchetti C, Schneider BJ, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol. 2018;36(17):1714-1768.
- Puzanov I, Diab A, Abdallah K, et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group. J Immunother Cancer. 2017;5:95.doi:10.1186/s40425-017-0300-z.
- Haanen JBAG, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl 4):iv119-iv142.
- Bertrand A, Kostine M, Barnetche T, Truchetet ME, Schaeverbeke T. Immune related adverse events associated with anti-CTLA-4 antibodies: systematic review and meta-analysis. BMC Med. 2015;13:211. doi:10.1186/s12916-015-0455-8.